【頭條公告掘金】
中國生物製藥(01177):新藥安羅替尼III期臨牀試驗完成受試者入組
智通財經APP訊,中國生物製藥(01177)公佈,該集團自主研發的“TRD205(AT2R受體拮抗劑)”片獲得中國國家藥品監督管理局批准開展藥物臨牀試驗,用於治療神經病理性疼痛。此前,TRD205片已獲得美國食品藥品監督管理局(FDA)批准開展臨牀試驗。新藥安羅替尼III期臨牀試驗,近期已順利完成全部受試者入組。
點評:AT2R抑制劑有望成爲神經痛領域重磅潛力品種,目前全球尚無同類產品上市。此外,公司研發的TQG3902“血管緊張素II”注射液獲得中國國家藥品監督管理局批准開展藥物臨牀試驗,用於提升患有膿毒症性休克或其他分佈性休克的成年人的血壓。該注射液是國內首個獲得該適應症臨牀批件的血管緊張素Ⅱ注射液。值得注意的是,1)近期,中國生物製藥公佈,公司以約人民幣2.1億的總估值出售附屬公司蘇州天晴興衛醫藥有限公司55%股權、連雲港正大天晴醫藥有限公司100%股權及浙江天晴中衛醫藥有限公司55%股權,出售所得總金額約人民幣 1.5億元。通過出售事項,該集團已剝離所有商業流通業務。出售事項有助於提升集團的經營業績。2)自2023年10月3日至2023年10月30日,公司根據股份購買計劃累計購買2690萬股股份,總代價約7288.5萬港元,剩餘股份購買額度約9.27億港元。公司後續將視乎市場情況繼續實施當前股份購買計劃。公司持續回購股份,是對公司未來發展前景的信心以及內在價值的認可。
【重點公告掘金】
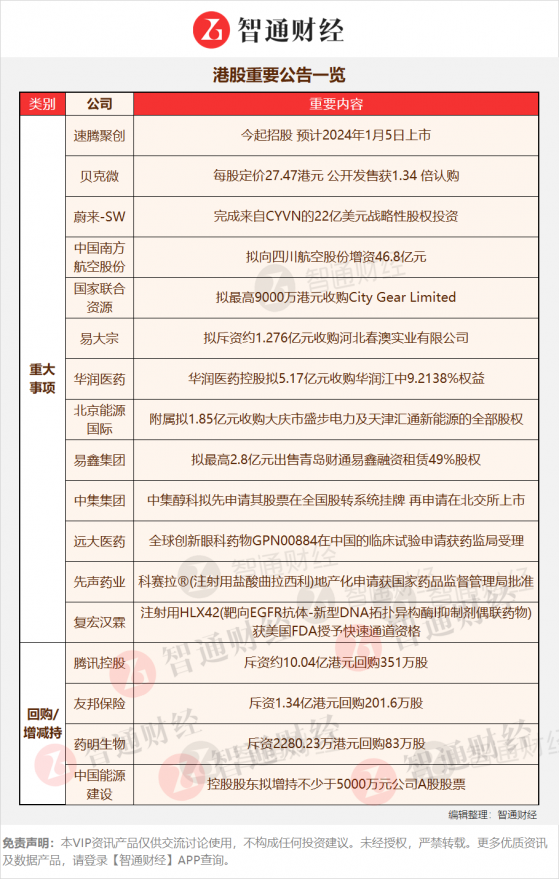
復宏漢霖(02696):注射用HLX42獲美國FDA快速通道資格 與華潤醫藥商業簽訂戰略合作
智通財經APP訊,復宏漢霖(02696)發佈公告,近日,注射用HLX42(靶向EGFR抗體-新型DNA拓撲異構酶I抑制劑偶聯藥物)(HLX42)用於經第三代EGFR 酪氨酸激酶抑制劑治療後疾病進展的EGFR突變的晚期或轉移性非小細胞肺癌患者的治療獲美國食品藥品監督管理局(FDA)授予快速通道資格(Fast Track Designation,FTD)。公司前三季度盈利達4.1億元,總收入同比增長84%。
點評:HLX42能夠抑制腫瘤生長,且具有良好的安全性。本次獲得Fast Track Designation認證,將有利於加快推進該新藥的臨牀試驗以及上市註冊進度。HLX42用於治療晚期/轉移性實體瘤的1期臨牀試驗申請分別於2023年10月及2023年11月獲國家藥品監督管理局(NMPA)和FDA批准。截止目前,全球範圍內尚無靶向EGFR抗體與小分子毒素偶聯藥物獲批上市。公司已在國內上市5款產品,在全球上市1款產品,產品覆蓋腫瘤、自身免疫疾病、眼科疾病等領域,此外還佈局了多元化、高質量的產品管線,在松江設有2個生產基地。公司亮眼的盈利主要是由於核心產品陸續實現商業化銷售並持續銷量擴大所致。近期催化:1)復宏漢霖近日宣佈,公司自主研發的伊匹木單抗生物類似藥HLX13在內地健康男性受試者中開展的1期臨牀研究完成首例受試者給藥。該產品擬用於黑色素瘤、腎細胞癌、結直腸癌、肝細胞癌等治療。2)復宏漢霖與華潤醫藥商業簽訂戰略合作,公司與華潤醫藥商業集團於2020年開啓合作,此次再度合作,雙方將共同提升藥品可及性。3)漢斯狀®相關生產線首次通過歐盟成員國GMP認證。
【港股重要公告一覽】
【免責聲明】本VIP資訊產品僅供交流討論使用,不構成任何投資建議。未經授權,嚴禁轉載。更多優質資訊及數據產品,請登錄【智通財經】APP查詢。