港股市場也即將迎來一家輔助生殖基因檢測公司:貝康醫療。貝康醫療是NGS細分市場—生殖領域的領軍龍頭企業,致力於高通量測序技術在生育健康領域的研發和臨床應用。
公司主要產品PGT-A試劑盒是首個也是唯一一個獲國家藥監局批準在中國進行商業銷售的PGT試劑產品,對比公司國内外潛在競爭對手候選產品距離獲得藥監局批準仍有數年之遙。
身處基因檢測生命科學賽道,產品競爭優勢明顯,貝康醫療有望成為香港市場第一支NGS基因檢測第一股,這為公司在港股打響第一槍,掙得良好估值打下基礎。
目前貝康醫療已通過上市聆訊,中信證券為獨家保薦人,公司最快將於下周初招股,計劃集資最少2億美元(約15.6億港元)。
基因檢測創新平台,擁有全生殖周期產品線
貝康醫療優勢較為明顯,公司是中國輔助生殖基因檢測解決方案的創新平台,具有首個也是唯一一個獲國家藥監局批準的三代試管嬰兒基因檢測試劑盒。
公司的PGT-A試劑盒是中國第一款在國家藥監局批準、且第一個實現商業化的三代試管嬰兒基因檢測試劑盒。
該試劑盒用於在胚胎植入母體前,來檢測試管嬰兒過程中胚胎的非整倍體,即染色體數目異常。
公司在2014年開始開發PGT-A試劑盒,並已經於2020年2月獲得國家藥監局的三類醫療器械注冊證,並於2020年4月開始啓動商業銷售PGT-A產品。
在往績記錄期,公司僅將PGT-A試劑盒的銷量作研究用途,同期PGT-A試劑盒的平均售價及銷量分别約為1253元及32388件。
同時,貝康醫療也是中國唯一一家擁有涵蓋整個生殖周期,並具有顯著技術優勢的創新平台,公司目前擁有5款自主研發的檢測試劑盒產品。
產品組合包括植入前胚胎的基因檢測試劑盒(PGT-A、PGT-M和PGT-SR產品),以及可以分别用在產前及產後階段檢測遺傳病的CNV和WES試劑盒。
除PGT-A試劑盒已經取得國家藥監局三類醫療器械注冊證外,其他4個產品正處於注冊檢驗或臨床前階段。
其中PGT-M試劑盒是檢測植入前試管嬰兒胚胎中的單基因缺陷,其無需進行患者特定預實驗生產流程驗證,從而將結果生成時間從約兩個月縮短為兩周,還能為患者減少檢測費用。
該試劑盒以無需預實驗步驟、速度更快、成本更低,和數據分析、解讀更準確的優勢,已經於2020年11月完成國家藥監局注冊檢驗,目前正在接受醫院倫理審查,並預計於2022年獲國家藥監局三類醫療器械注冊證。
PGT-SR檢測植入前試管嬰兒胚胎中染色體結構重排,包括缺失、重復、倒位和異位。由於不同染色體存在多種潛在結構重排,故而需要非標準化、定制測試,導致該檢測大規模臨床應用相對困難。
但公司的PGT-SR試劑盒為檢測染色體結構重排提供有效臨床解決方案,且生產時間更短、費用更少,進而可能成為中國第一個具有大規模臨床應用潛力的標準化商業產品,並預期於2024年獲國家藥監局注冊批準。
PGT-A、PGT-M和PGT-SR三款試劑盒均是基於二代測序(NGS)技術,共同構成了PGT領域一個完整檢測試劑盒係列,進一步鞏固貝康醫療在三代試管嬰兒基因檢測試劑盒市場的主導地位。
除自主開發產品外,公司還分銷達安生產的非侵入式產前檢測試劑盒NIPT,和獲國家藥監局批準用於PGT的唯一NGS測序儀DA8600。其中後者是全球主流的NGS平台之一,是中國批準用於PGT的唯一一個測序儀。
臨床驅動型研發鋪路,規模化生產業蓄勢待發
探究貝康醫療之所以能成為NGS細分領域龍頭企業,以臨床為導向的研發模式、強大的研發能力,以及具有成功經驗的專業知識,是公司競爭力的關鍵驅動。
從研發投入就能看出公司對技術的重視。2018、2019年,公司研發開支總額分别為1880萬元,1990萬元,2020年9月30日止九個月為2200萬元,分别佔當期營業收入比重分别為57.7%、35.7%、38.4%。
在以臨床為導向的研發模式下,公司擁有強大的研發能力,可開發一站式、定制化綜合的生殖遺傳學解決方案。
公司不僅自主研發了覆蓋全生殖周期的檢測試劑盒,還開發了一套專注於胚胎檢測、管理和存儲的硬件,以補充基因檢測試劑盒產品。
目前公司已經開發一種可自動處理和管理胚胎檢測的自動化工作站,以及中國第一個用於胚胎儲存的全自動、全數字化智能超低溫存儲儀,成為同類產品中第一個獲得歐盟CE標識(健康和安全的金標準)的胚胎存儲設備。
除了自主開展研發項目外,公司還與中國大型醫院及生殖診所、全球生命科學及生物技術公司、學術機構等主要業務夥伴合作,以聯合建立實驗室等多重合作方式來滿足一線臨床治療最迫切的需求。
三代試管嬰兒在中國發展歷史短暫。首個服務提供商許可證於2001年頒發,2019年中國具有執業資格的也僅有70家醫院和生殖診所,對新設備及技術有著巨大的渴求。
貝康醫療針對個性化需求,為客戶提供一站式定制化綜合解決方案。不僅僅提供檢測試劑盒和硬件設備及儀器,還提供實驗室設計、運作和管理,售前和售後技術支持等意見和指引等,幫助客戶從零開始建立並進一步提升生殖基因檢測、分析和咨詢能力。
基於在PGT領域優勢地位,貝康醫療還參與起草國家《胚胎植入前染色體非整倍體檢測試劑的質量控制技術評價指南(高通量測序法)》,參與制定PGT-A產品的國家標準,起草中國第一部PGT技術質量指南和國家行業標準。
覆蓋整個業務鏈條的研發模式奠定貝康醫療綜合能力和行業地位。擁有最先進的平台,貝康醫療具有研發、產品制造、注冊到商業化的綜合能力,更有利於公司將創新技術轉化為大眾化的商業產品。
在獲得第一張商業化門票後,公司大規模生產箭在弦上。目前貝康醫療開始籌劃對PGT-A試劑盒進行商業化規模生產。
公司在蘇州擁有1364平方米的生產廠房,按照中國GMP要求設計,擁有兩間符合國際清潔等級劃分標準ISO14644-1清潔等級標準的ISO7級清潔車間,產能每年400萬人份。
值得稱道的是,該生產廠房生產線高度自動化,可以生產和組裝所有内部開發的產品。
佔據黃金賽道,受資本寵愛
貝康醫療所處的賽道正是生命科學的風口。
雖然三代試管嬰兒在中國剛剛起步,基於龐大的人口基數,以及人們對試管嬰兒治療在内的PGT的認識和接受程度不斷提高。
中國政府於2016年出台政策在中國推廣PGT。在政策催化下,獲國家衛健委頒發PGT許可證的醫院和生殖診所數量從2016年40家增加至2019年的70家,未來PGT中心還將繼續增加。
在商業化推動下,PGT在中國的滲透率預期將從2019年的3.8%提高至2024年的18.4%。與美國2018年的滲透率35.2%相比,中國PGT的滲透率增長潛力巨大。
隨著貝康醫療PGT-A試劑盒成功商業化,將加速中國PGT試劑市場快速增長。
市場規模方面,根據弗若斯特沙利文報告,按基於出廠價銷售收入計,PGT試劑市場將從2020年的0.96億元,增加至2025年的34億元,復合年增長率為103.8%,並預期於2030年進一步增加至147億元,2025年至2030年的復合年增長率34.2%。
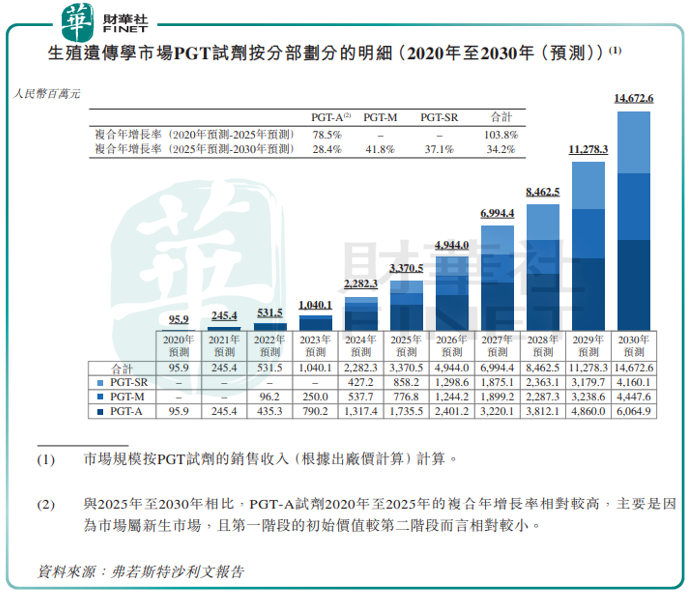
憑借在PGT領域領先地位,貝康醫療未來還想通過戰略定位服務於更大的生殖遺傳學醫療器械市場。
受不孕率日益提升、輔助生殖治療需求不斷增長,基因檢測可購性不斷增加,中國生殖遺傳學醫療器械市場也在快速發展。
按基於出廠價計算銷售收入計,已從2015年的13億元增長至2019年的34億元,復合年增長率為28.4%,並預期將於2024年達到112億元,2019年至2024年的復合年增長率為26.5%。
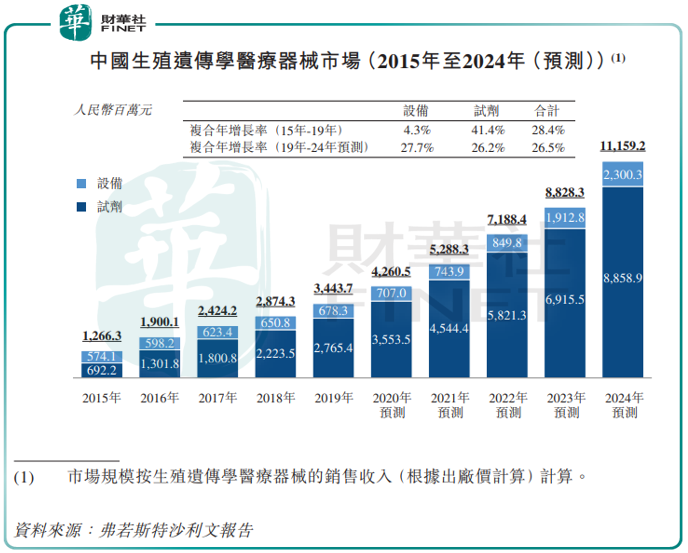
在PGT領域佔據領先地位,以及對更大市場的戰略願景,讓貝康醫療備受資本青睐。招股書顯示,成立時間不長的貝康醫療已經完成D輪融資,精通醫療行業投資的大鳄高瓴資本赫然在列,IPO前持股比例約為6.82%。
恒瑞方圓旗下中誠方圓二期持股7.59%,元禾控股旗下元禾原點持股6.15%;元生創投通過蘇州新建元持股5.71%。
手握重磅商業化產品,在研資產管線覆蓋整個生殖周期,NGS檢測領域細分龍頭貝康醫療能否在港股市場打響基因檢測第一槍,讓我們拭目以待。
