3月7日,作為國内未盈利生物醫藥公司之一的華領製藥(02552-HK)發佈了全年的業績。
據業績報顯示,公司經調整虧損同比增加86.3%至人民幣2.79億元。除了虧損加大外,公司今年的研發支出費用持續高走,全年研發支出同比增長114.7%至2.69億元人民幣(單位下同)。這主要的原因是華領製藥目前併無主營收入,收入隻來源於銀行的利息與政府的補貼。因之,隨著公司的產品管線投資的加大,虧損敞口就會加大。
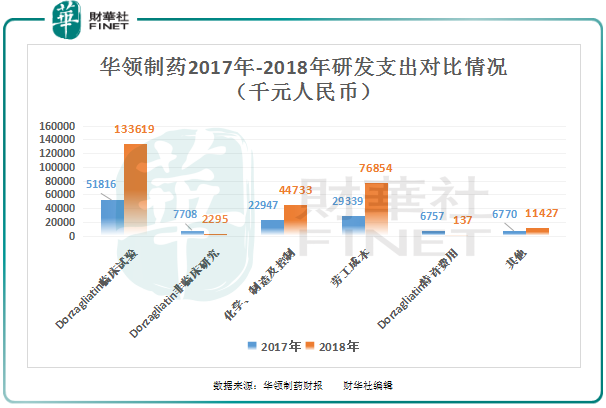
從公司的研發支出上看,華領製藥的研發支出增加主要來源三大項目,即Dorzagliatin臨床試驗、化學、製造及控製及勞工成本。
Dorzagliatin臨床試驗研發開支同比增長157%至1.336億元,主要增長的原因是由於III期臨床試驗進展及2018年開展的額外I期臨床試驗有關的成本增加。
化學、製造及控製研發開支同比增長94.94%至4473萬元,主要增長的原因是在2018年完成API製造工藝驗證所緻;
勞工成本研發開支同比增長161.95%至7685萬元,主要增長的原因是由於員工人數從20名增至75名,導緻現金薪酬增加2270萬元及以股份為基礎的付款增加2480萬元。

從公司的產品管線上看,公司目前有四個試驗批次,七個產品正在開發中。其中, Dorzagliatin(HMS5552)和 mGLUR5是華領醫藥主要有兩個核心產品。核心產品 Dorzagliatin HMM030用於治療2型糖尿病,是該公司目前最接近進入市場的產品,也是全球第一個進入第III期臨床試驗的葡萄糖激酶激活劑(GKA)。截至2019年2月28日,公司已完成逾450名患者的招募,預計於2019年第四季度前發佈首個24週結果。
對於治療帕金森病患者左旋多巴誘發的功能障礙的mGLUR5(HMM0112),公司將計劃的臨床前研究。基於該等研究的結果,公司計劃隨後於2020年作出Go/No GO決策。
Dorzagliatin+Metformin是針對具有二甲雙胍耐藥性的2型糖尿病患者。該產品已經進行到III期臨床試驗。預計將於2019年中期前完成招募,併於2020年第一季度前發佈首個24週結果。
Dorzagliatin+DPP-4(西格列汀)是針對具有2型糖尿病患者。目前處於I期臨床試驗階段。公司已發佈於2019年1月服藥的首位患者,預計將於2019年年底前完成試驗併發佈結果。
試驗HMM0112中的產品是針對具有2型糖尿病患者。目前處於I期臨床試驗。公司已確定臨床地點,預計將於2019年上半年讓首位患者服藥,預計將於2019年年底前完成試驗併發佈結果。
從產品管線進度上看,公司有兩項產品處於III期臨床試驗階段,華領製藥預計在2019年第四季度前發佈單藥療法試驗(HMM0301)的首個24週III期臨床試驗結果,於2020年第一季度前發佈與二甲雙胍聯合用藥試驗(HMM0302)的首個24週III期結果。 對此,華領製藥的產品在2019年仍然未商業化,那麽2019年公司是虧損可能隨著產品管線投資的加大,虧損敞口會更大。
3月8日上午,華領製藥在港舉行2018年全年業績發佈會,執行董事、首席執行官兼首席科學官陳力博士攜執行董事、執行副總裁及首席財務官林潔誠出席併答記者問。
陳力博士現場表示,公司在中國的新藥申請基本在10到12月之内進行批復,預期在2021年中期可以正式上市,且公司可能會進行一些產品的引進,可能有一到兩個億的投入。
更多現場對話内容如下:
Q:產品進入三期臨床試驗,何時可以面市?
A:(陳力)修復人體的傳感器,修復人體的血糖調節,作為一個新的治療方法,通常需要10年以上的臨床研究才能最終臨床試驗確認安全有效性以及對患者的保護作用。目前我們已經完成了前面很重要的兩個階段,一個是它的安全性和耐受性。第二個是在二期臨床驗證它的科學性以及治療效果。三期臨床在二期的基礎上在更多的患者人群中重復相關實驗,最終確認臨床用藥標準。
估計兩個臨床試驗有1000多個病人參與研究,進度上在今年的第四季度可以報道一部分糖尿病患者的治療結果,期待比二期更好。另一個治療二甲雙胍用藥失敗的患者,加上我們的藥來治療糖尿病。預期在明年年初可以給大家報導。
希望通過這兩個實驗結果,動物實驗的結果,以及藥物生產的結果,向中國藥監局遞交新藥上市申請。中國的新藥申請基本在10到12月之内進行批復,我們預期在2021年中期可以正式上市。
Q:藥物如何定價?
A:(陳力)作為一個口服的降糖藥,目前中國醫保對於降糖藥的保護的範圍大概在6000至7000元,我們的價格可能不會比這個價格高太多。具體依然要有公司市場部、產業開發部和藥價局共同商討之後定下來。
Q:預計成本會有兩億的增加?
A:(陳力)我們按照預期完成兩個三期臨床,四個一起臨床都是為了申報新藥上市,然後還要完成藥物的生產化進程,這個總體上在8億左右。如果明年會加速對糖尿病個性化治療投入,我們有可能會2個億在新的領域。還有一種可能,國外藥廠在國外上市,有的藥和我們的藥有比較好的協同作用,能夠擴大產品管線,我們可能會進行一些產品的引進,可能有一到兩個億的投入。