文章來源: 弗若斯特沙利文公眾號
全球惡性腫瘤發病率不斷增長,惡性腫瘤作為主要死因的情況日漸加劇,已成為世界性的醫學難題。細胞免疫治療作為惡性腫瘤治療體系中的重要組成部分,通過激發機體對腫瘤的自然免疫防禦、重建免疫微環境等方式,從而控制和殺傷腫瘤細胞,為晚期惡性腫瘤患者、既往對多藥產生耐藥反應的腫瘤患者、容易復發的腫瘤患者的長期生存獲益帶來了更多的治療可能性。其中,基於iNKT細胞的新一代細胞免疫療法展示出良好的抗腫瘤潛力,是抗腫瘤療法的前沿研究方向之一,有望安全有效地抑制癌症的惡化、復發及轉移,並且滿足實體瘤領域迫切的治療需求。
本文將回顧iNKT細胞療法的技術叠代歷程,匯總最新的研究進展,挖掘細胞療法行業的未來發展趨勢,以期為腫瘤免疫治療領域的參與者和關注者提供參考。
01.腫瘤細胞免疫療法近年來開發熱度高漲,基於不同效應細胞的細胞療法湧現
在過去的十餘載里,腫瘤免疫學、生物信息學等多個學科快速發展和交叉融合,促使腫瘤免疫治療領域的多種新興治療手段進入臨床研究階段,例如,過繼性細胞療法,非特異性免疫藥物,溶瘤病毒等主要治療策略。
過繼性細胞療法作為一種被動免疫療法,需要從腫瘤患者體内分離出活性免疫細胞,在體外經過基因工程化改造、功能鑒定和篩選激活,大量擴增後重新回輸到患者體内,以達到清除腫瘤的目的。根據效應細胞是否有外源基因的表達,過繼性細胞療法可分為兩類,一類需要對免疫細胞進行基因工程化改造以提高免疫細胞對腫瘤細胞的靶向性識别能力,例如,嵌合抗原受體修飾T細胞(CAR-T)療法、T細胞受體嵌合T細胞(TCR-T)療法以及嵌合抗原受體修飾自然殺傷細胞(CAR-NK)療法等。另外一類是直接從患者的外周血或腫瘤組織中分離篩選出腫瘤浸潤的免疫細胞,例如,腫瘤浸潤免疫細胞(TILs)療法、細胞因子誘導的殺傷細胞(CIK)療法、淋巴因子激活的殺傷細胞(LAK)療法、自然殺傷細胞(NK)療法、自然殺傷T細胞(NKT)療法等。
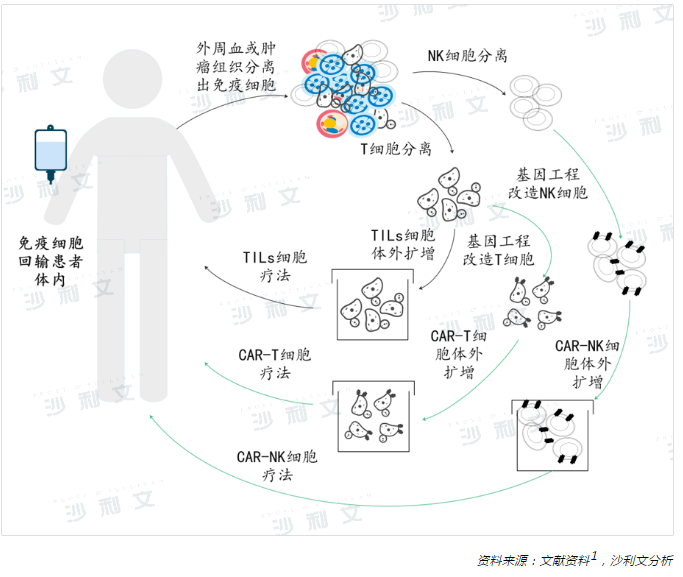
作為過繼性細胞療法的代表, CAR-T療法在血液惡性腫瘤領域展示出良好的臨床療效,成為備受關注的焦點。自2017年美國食品與藥品管理局(FDA)相繼批準諾華的Kymriah®和吉利德的Yescarta®上市後,CAR-T領域的研發熱潮蔓延至全球,呈現出高歌猛進的態勢。截至目前,全球範圍内累計已有9款CAR-T產品惠及患者。自2021年 CAR-T療法在我國正式商業化啓程後,我國目前已有3款獲批上市的CAR-T產品。
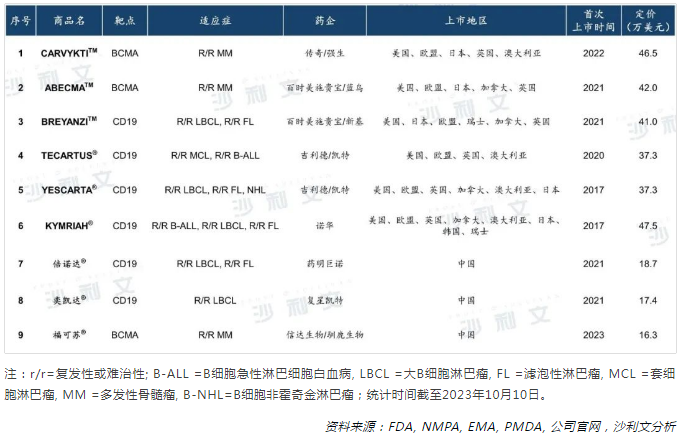
近年來,圍繞著腫瘤相關性抗原、CAR結構設計及其信號轉導、腫瘤浸潤和調節免疫抑制性腫瘤微環境等多個方面,革新CAR-T療法的研究策略不斷湧現。CAR-T療法已然取得突破性的臨床進展,然而其在臨床應用上依然存在諸多局限性,亟待進一步攻克。
在適應症方面,受制於腫瘤特異性抗原缺乏和免疫抑制性腫瘤微環境等因素,CAR-T療法難以有效地抑制實體瘤的進展。儘管CAR-T治療血液系統惡性腫瘤的緩解率較高,但達到持續緩解仍是挑戰,由於血液腫瘤患者體内 CAR-T 細胞生存時間短,影響著療效的持久性,部分患者仍會出現疾病復發的現象。同時,CAR-T療法的脫靶效應及細胞因子風暴反應可能會對患者帶來嚴重的副作用,這也限制了CAR-T療法的廣泛使用。此外,CAR-T療法需要個體化、定制化的治療流程,復雜的制備過程導致接受CAR-T治療的患者終端治療費用高昂,患者可負擔性低。
基於以上困境,科研人員正將目光轉向其他應用前景良好的效應細胞,如iNKT細胞,試圖為腫瘤免疫治療開辟新的有效路徑。
02.iNKT細胞具有獨特的生物學特性和功能
20世紀80年代,NKT細胞最先發現於小鼠體内。1986年,日本免疫學界的谷口克團隊在小鼠血液内發現一種表達恒定Vα14基因的T細胞抗原受體(TCR),擁有與其他TCR不同的基因結構。直至20世紀90年代後期,科學家在人體中也發現了NKT細胞,並將其首次命名。自此,天然存在的一種T細胞亞群——自然殺傷性T(NKT)細胞進入了研究者的視野,因其獨特的表型和功能,NKT細胞受到了全球研究者的高度重視,一系列圍繞著細胞學特性、分型、功能等方面的深入探究活動陸續開展。
2004年,《Nature Reviews Immunology》刊登了一篇名為 NKT cells: what’s in a name? 的綜述,闡述了NKT細胞在免疫反應中的調節作用及其細胞亞群的存在,試圖澄清NKT細胞與類NKT細胞的區别2。相關研究結果不斷湧現,闡明NKT細胞在免疫系統中的生物學意義,為後續探究NKT細胞在腫瘤免疫中的作用機制奠定了堅實的理論基礎。

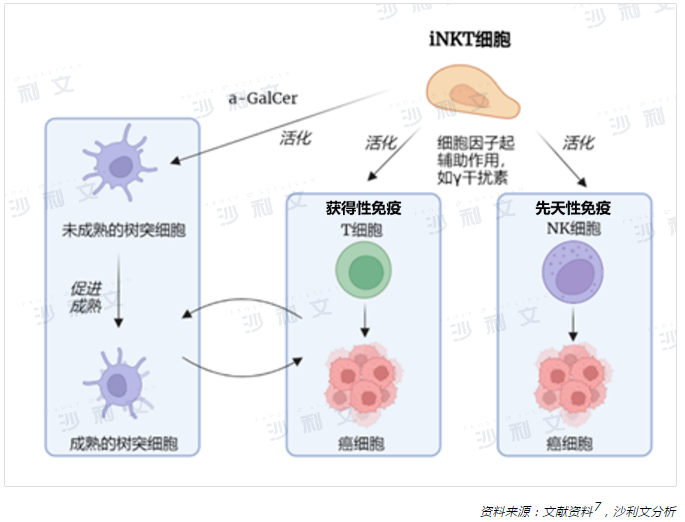
在對NKT細胞的探索歷程中,研究最為細致且深入的一類細胞亞群是特異性恒定表達T細胞受體的I型NKT細胞,即恒定自然殺傷T(iNKT)細胞。iNKT細胞在胸腺中發育,聚集在肝臟中,其次分佈在脾、骨髓、淋巴結、皮膚粘膜和外周血等其他部位3,4。在外周血中,iNKT細胞約佔循環T細胞0.01-0.1%5。儘管iNKT細胞數量稀少、來源有限,但其在腫瘤免疫治療的應用潛能日益凸顯。iNKT細胞由於共同表達T細胞和NK細胞的典型表面受體,因而發揮著多種抗腫瘤效應。iNKT細胞不僅是先天性免疫的組成細胞,同時也是適應性免疫應答的參與者和調節者6。
03.多項研究進展正在逐步揭示iNKT細胞確切的抗腫瘤機制
當擔任效應細胞的角色時,iNKT細胞的高度特異性天然糖脂配體——α-半乳糖神經酰胺(α-GalCer)有助於激活iNKT細胞產生大量的免疫調節因子。活化的iNKT細胞能極大地增強自身直接殺傷CD1d陽性腫瘤細胞活性的能力,主要通過凋亡信號轉導途徑例如Fas/FasL,釋放穿孔素、顆粒酶B和腫瘤壞死因子(TNF-α)相關的誘導凋亡配體等途徑8,9,10。
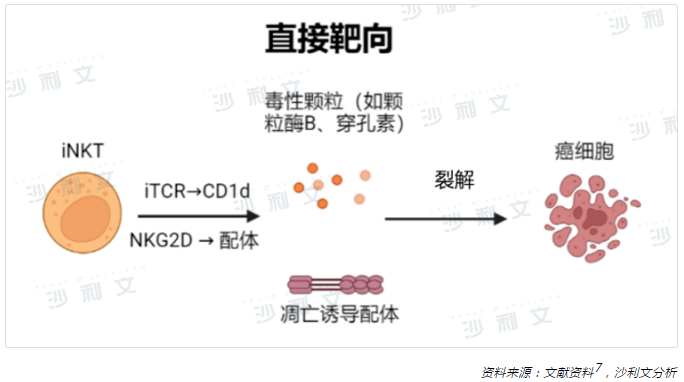
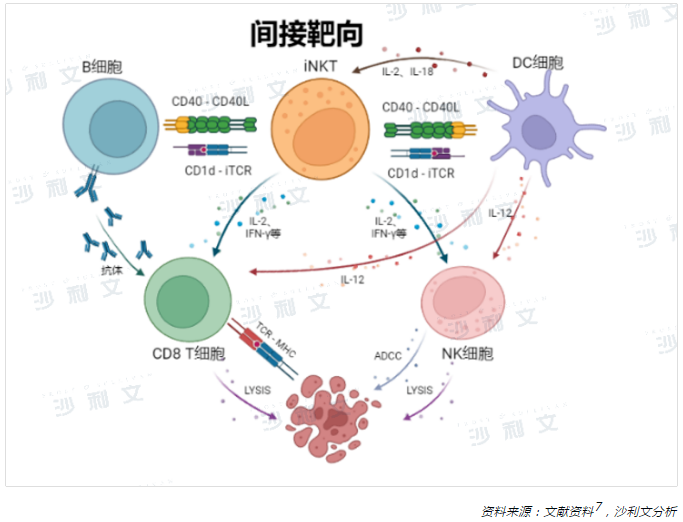
在腫瘤免疫監察中,除了直接靶向腫瘤外,iNKT細胞也能間接介導腫瘤細胞毒性,通過激活多種免疫效應細胞進而間接發揮抗腫瘤作用。α-GalCer刺激iNKT細胞後,活化的iNKT細胞可分泌白細胞介素2(IL-2)、白細胞介素4(IL-4)、白細胞介素17(IL-17)、幹擾素-γ(IFN-γ)和腫瘤壞死因子(TNF-α)等多種促炎性細胞因子,驅動著廣譜的免疫細胞發揮抗腫瘤作用11。
其中,產生的IFN-γ、IL-2等細胞因子可激活NK細胞,使其靶向殺傷主要組織相容性復合體(MHC)陰性腫瘤細胞,克服MHC下調導致的免疫逃逸機制。同時,分泌的IFN-γ也會激活CD8+T細胞殺傷MHC陽性腫瘤細胞,發揮特異性免疫作用12,13。此外,IFN-γ可主動募集並誘導抗原呈遞細胞——樹突狀(DC)細胞成熟,活化免疫功能不全的免疫系統。成熟的DC細胞與iNKT細胞相互作用後產生的細胞因子如IL-2可誘導iNKT細胞分泌更多的IFN-γ,增強抗原呈遞,從而形成正向反饋環以提供強大的抗腫瘤免疫功能。
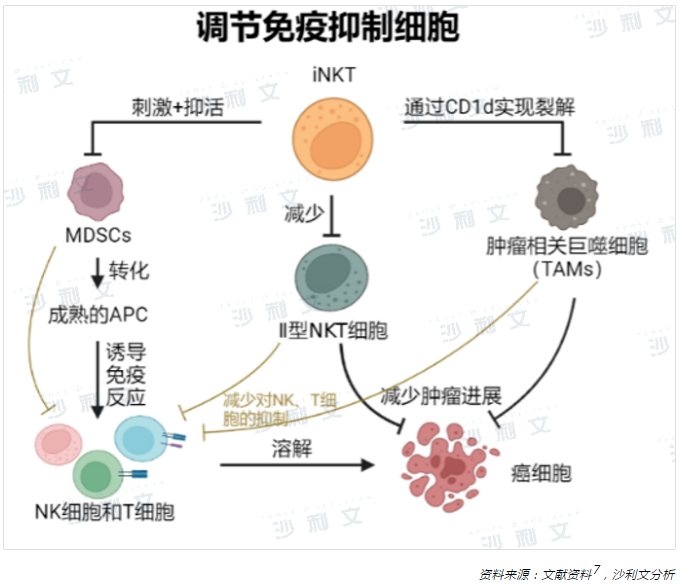
當iNKT細胞作為免疫抑制性調節細胞時,其受到抗原刺激後能夠快速、高效地分泌大量的細胞因子和趨化因子,調控機體免疫耐受環境,提高機體免疫應答能力。髓系來源的抑制細胞(MDSCs)、腫瘤相關巨噬細胞(TAMs)和調節性T細胞(Tregs)等免疫抑制細胞積聚在腫瘤微環境(TME)中,抑制正常免疫細胞發揮作用,促進腫瘤生長和進展14。而iNKT細胞能夠通過多種途徑抑制並清除表達CD1d的免疫抑制細胞如MDSCs和TAMs,從而阻礙腫瘤生長、發展和轉移15,16,17。II型NKT細胞在TME中的出現頻率也很高,主要起到免疫抑制作用。而iNKT細胞的激活能夠減少II型NKT細胞在TME中的數量和出現頻率,也達到一定的降低免疫抑制作用18,19。此外,iNKT細胞還可以通過產生血管活性因子,如TNF-α和IFN-γ,抑制腫瘤相關血管的生成和功能,阻斷腫瘤的營養和氧氣供應,從而抑制腫瘤生長和擴散。
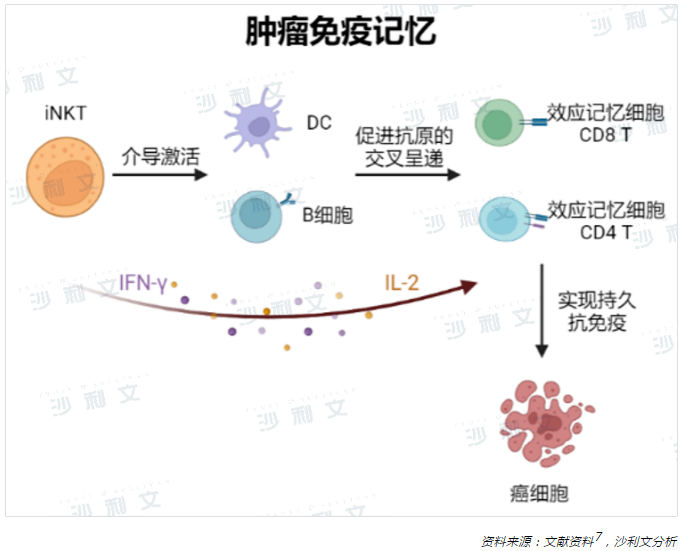
iNKT細胞抗腫瘤的另一個重要途徑是能夠促進腫瘤靶向免疫記憶。研究表明,iNKT細胞具有促進功能性記憶的特徵20,有望幫助機體形成持久有效的免疫反應。CD8+T細胞能夠有效清除腫瘤細胞,其發揮效應功能後,其中少數分化成為壽命長的記憶性CD8+T細胞,從而在機體中發揮持久的抗腫瘤作用。在腫瘤模型中,活化的iNKT細胞能增強記憶性CD8+T細胞介導的抗腫瘤免疫功能21。研究表明,負載a-GalCer的腫瘤細胞可誘導抗腫瘤反應,並以DC依賴性方式產生記憶性CD8+T細胞22。同時,新興的CAR-iNKT細胞療法也可促進生成記憶CD8+T細胞23。iNKT細胞對CD8+T細胞的調控作用是復雜的,具體的作用機制目前很大程度上仍需進一步探索。
04.眾多研究表明,iNKT細胞療法具有人群普適性、治療有效、適應症廣泛、異體治療可行性高的應用優勢
人群普適性
iNKT細胞的T細胞受體(TCR)與抗原呈遞細胞(APCs)上的CD1d相互作用後起到活化iNKT細胞的作用。而TCR所表達的Vα-24和Jα-18鏈對於人類是共通的,不同個體的iNKT細胞均可以對CD1d分子遞呈的抗原做出反應,這使得iNKT細胞療法在人群中具有廣泛普適應用的治療潛力,包括那些由於人體白細胞抗原(HLA)分子多樣性而無法接受常規細胞療法的患者。
治療有效性
免疫系統在識别和攻擊腫瘤細胞時,腫瘤細胞的變異和免疫逃逸機制極大地影響了治療效果。而iNKT細胞可以同時激活先天性免疫和獲得性免疫系統,激活抗原特異性的CD8+T細胞和NK細胞,同時靶向MHC陽性和陰性腫瘤細胞,克服因腫瘤細胞MHC下調導致的免疫逃逸機制。因此,理論上iNKT細胞能清除已產生腫瘤抗原的細胞和未產生腫瘤抗原的細胞,或新出現的變異腫瘤細胞,從而有望抑制腫瘤的惡化、轉移及復發。
異體治療的可行性
移植物抗宿主病(GvHD)是限制異體CAR-T療法可行性的主要障礙之一,為了避免GvHD的發生,生成通用型CAR-T細胞的關鍵步驟是利用基因編輯手段去除内源性TCR基因片段。而臨床研究表明,在同種異體治療過程中,iNKT細胞可以減少自體T細胞的活化,降低GvHD發生的可能性24。與其他常見的效應細胞如T細胞、TIL細胞以及NK細胞相比,iNKT細胞是適用於異體治療的理想候選者。
受到自身免疫狀態的限制,部分患者無法從自體細胞回輸治療中獲益。而從健康的供體採集得到的iNKT細胞,具有更強的細胞活性與殺傷能力,能夠更高效地清除腫瘤。同時,異體iNKT治療產品具有快速可用的優勢。自體治療需先收集患者自身的免疫細胞,體外擴增後再進行回輸治療,此過程通常耗時久、價格昂貴。相比之下,異體治療使用預先制備好的細胞產品,以「現貨型」細胞產品供應給患者使用,提高治療效率及治療費用的可負擔性。
適應症廣泛,可擴展至實體瘤領域
iNKT細胞療法在腫瘤、移植耐受、自身免疫性疾病、炎症以抗感染等領域均顯示著治療潛力。其中,實體瘤的腫瘤微環境具有高復雜性和抗原異質性,開發針對實體瘤的治療策略是一項重大挑戰。iNKT細胞療法圍繞多個治療途徑提高實體瘤的治療效果,有望實現對實體瘤的有效控制。
首先,iNKT細胞可以活化患者體内由於腫瘤細胞而弱化的免疫細胞群,對一系列不同類型的腫瘤產生廣譜反應。其次,iNKT細胞良好的免疫調節功能將更好地克服實體瘤的免疫抑制性腫瘤微環境。同時,iNKT細胞的TCR能夠識别和結合腫瘤細胞表面上的非多肽類抗原,而不僅僅局限於特定的抗原。這種跨界識别能力使得iNKT細胞在不受抗原異質性的限制下,廣泛地攻擊多種類型的實體瘤細胞。此外,與T細胞相比,iNKT細胞能夠表達更多的趨化因子受體如CCR1、CCR2、CCR4等,使得iNKT細胞在腫瘤中的浸潤能力更強,也能募集更多種免疫效應細胞浸潤至腫瘤微環境内25。
05.從理論跨越到實踐,動物模型和人體試驗中的研究成果展現著iNKT細胞的良好抗腫瘤效果
前期基於小動物模型所開展的研究證實了iNKT細胞的抗腫瘤作用。在一項基於小鼠B16黑色素瘤的肝轉移模型的臨床前研究中,將分離得到的小鼠DC細胞在體外用α-GalCer處理後回輸至小鼠體内,使小鼠體内的iNKT細胞活化而產生高效的抗腫瘤活性。在此項研究中,將B16黑色素瘤細胞注入小鼠脾臟後,7天後靜脈注射α-GalCer/DC對小鼠進行治療。一段時間後觀察到0.5-1mm左右的轉移結節可完全消退,這說明α-GalCer/DC能夠激活小鼠體内的iNKT細胞,並有效抑制小鼠模型中黑色素瘤的轉移26。
然而,人體中iNKT細胞含量遠低於小鼠,且腫瘤患者體内的iNKT細胞數量減少、功能減弱27,導致對iNKT數量和功能依賴的α-GalCer治療效果不夠理想。此外,人體内含有有α-半乳糖的抗體,能夠降低α-GalCer 的治療效果28。因而,直接注射α-GalCer難以充分發揮自體iNKT細胞的抗腫瘤免疫作用。Giaccone等首次利用α-GalCer進行腫瘤免疫治療的臨床試驗,研究結果顯示,患者未出現明顯的症狀緩解,且患者血清中細胞因子的水平與α-GalCer用量無關,而與用藥前患者本身體内iNKT細胞的數量有關29。另一種治療方式為注射荷載α-GalCer的抗原呈遞細胞,研究證明其可以促進iNKT 細胞數量和IFN-γ表達水平的增加,增強機體抗腫瘤免疫功能30,31,32。然而,不同患者的療效差異較大,導致難以預測病人預後,沒有明顯的臨床獲益。
iNKT細胞的數量和功能對於iNKT細胞免疫治療的臨床應用是至關重要的,在前期進行的人體臨床試驗中,在體外擴增iNKT細胞再回輸到患者體内的過繼性iNKT細胞療法展現出了良好的臨床療效,也是目前主流應用的治療方案。
Motohashi等對6位手術切除病竈後再次復發的肺癌患者,體外擴增培養iNKT細胞後靜脈注射至患者體内。結果顯示,患者外周血中iNKT細胞數量增加,細胞因子IFN-γ水平上升。經治療後,4例患者的病情得到了有效控制33。
Yamasaki等對10位復發性頭頸部鱗狀細胞癌患者進行了過繼性iNKT細胞免疫治療。採集患者外周血,經過α-GalCer刺激後,體外擴增再經腫瘤灌注血管回輸,並將載有α-GalCer的抗原遞呈細胞經鼻腔黏膜注射。結果顯示,其中9例患者的外周血中iNKT細胞數量增加,且最終5例患者實現了腫瘤消退,5例患者病情得到部分緩解34。
Lu Jun團隊聯合GK Life實驗室完成了自體iNKT細胞對10例肝癌患者治療的安全性研究。研究中採用3+3臨床試驗設計的方式入組,其中一例最大靜脈輸注總量達到1×1010 cells/m2,沒有觀察到超過3級的毒性反應。實驗結果表明了iNKT細胞的安全性良好,患者對其耐受性良好。這一結果實現了該研究的預期安全性的目標,同時也治愈了多例肝癌中晚期患者35。Lu jun團隊還剖析了其團隊治療1例巨大肝癌,同時伴有乙肝肝硬化及骨轉移的病人,通過iNKT細胞及後期聯合PD-1抗體治愈了此病人36。近期,Lu jun團隊聯合GK Life實驗室報道了一項入組了60例中晚期肝癌患者的二期臨床研究結果。在此研究中,30名患者接受了iNKT細胞聯合治療,結果顯示其中位生存期、客觀緩解率、疾病控制率、生命質量和不良反應等多項指標均優於另外30名未接受iNKT細胞治療的患者。這項研究再一次證明iNKT細胞療法在中晚期肝癌治療中的重要作用37。
iNKT細胞免疫治療面臨的重大挑戰之一是患者體内iNKT細胞的低浸潤和功能降低,並且患者體内的腫瘤細胞CD1d的表達下調,導致治療效果可能會受到限制。另一個挑戰是如何制定安全高效的細胞擴增方案以確保過繼回輸的iNKT細胞數量能夠符合回輸要求。為了應對這些挑戰,許多研究對iNKT細胞免疫療法進行了改進。
改進現有療法的一種方式是將其與產生協同反應的其他療法相結合,以提高iNKT細胞免疫療法的臨床療效。在臨床前和臨床試驗中,iNKT細胞免疫療法已經與化療、溶瘤病毒和其他免疫療法進行了聯合試驗。改進方式還包括結合iNKT細胞和嵌合抗原受體修飾(CAR)而得到的CAR-iNKT細胞產品。通過基因工程修飾,CAR-iNKT細胞被賦予了腫瘤抗原靶向性,可以直接靶向表達特異性抗原的腫瘤細胞,而不受限於MHC的表達或抗原呈遞。同時,CAR-iNKT細胞具有高度可塑性,不同類型的CAR能夠識别不同的腫瘤抗原,還可以增強其免疫調節能力或者抗腫瘤活性。此外,由於難以從免疫抑制的患者獲得足夠的人外周血單核細胞(PBMC)進行體外擴增和回輸iNKT細胞,一種應對策略是使用來自患者組織的誘導多能幹細胞(iPSC)誘導分化成為iNKT細胞,且這種誘導而得到的iNKT細胞能夠分泌大量IFN-γ,其抗腫瘤功效進一步獲得提升。
06.全球多家研發企業加快佈局,日益增長的關注與投入推動臨床進展
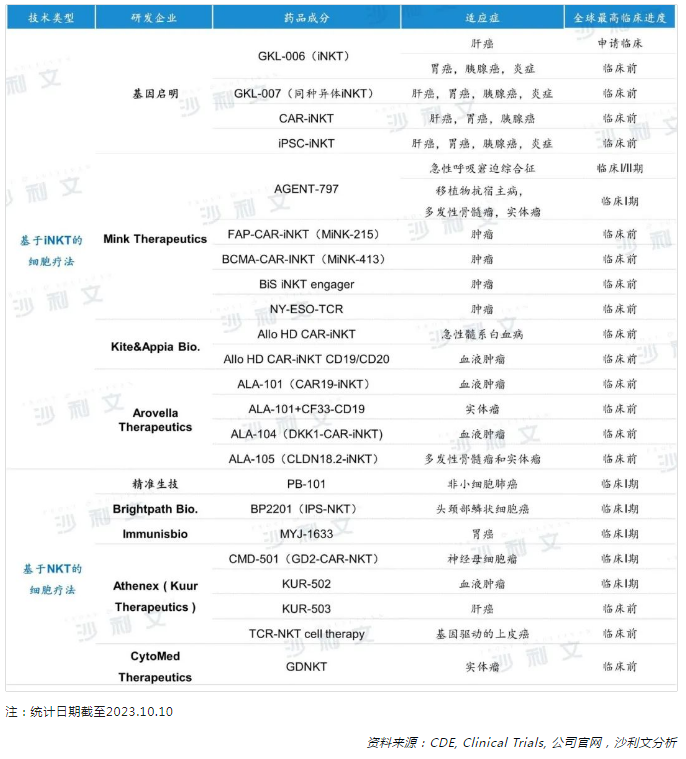
全球範圍内,基於iNKT細胞的免疫治療策略逐漸為行業所認可。近些年來,越來越多的科研團隊和國際生物醫藥公司積極佈局,持續為iNKT細胞療法的研發帶來創新動力。在國内,現階段主導iNKT細胞療法開發的主要為科研組織和研究機構,代表性的研發廠商北京基因啓明生物科技有限公司2015年已入局該領域,處於研發的前序隊列,即將開啓注冊性臨床試驗。國外研發廠商數量相對較多,例如Mink Therapeutics、Kite&Appia Bio.、Arovella Therapeutics等。
從研發進度上來看,iNKT細胞療法作為腫瘤領域的新型治療策略,其研發進程尚處於早期研究階段,多數臨床管線的進度為臨床前階段,相關評估和驗證其安全性和療效的研究和臨床試驗正在持續推進。
從產品管線的適應症上來看,除了細胞免疫療法傳統應用的血液瘤領域之外,iNKT細胞療法已邁入實體瘤領域,目前一些初步的臨床研究結果證實其對於某些實體瘤具有良好的治療效果。同時,美國Mink Therapeutics研發的CAR-iNKT產品已將治療方向轉向其他潛力方向,如移植耐受、自身免疫性疾病和炎症。
國内iNKT細胞療法在研廠商
- 基因啓明
北京基因啓明生物科技有限公司專注於開發iNKT細胞實體瘤治療管線,是全球首家開發iNKT細胞系列管線的企業,目前已完成iNKT細胞治療中晚期肝癌的I/II期臨床研究。其iNKT細胞治療產品「GKL-006注射液」在NMPA的注冊臨床試驗申請已獲得CDE受理。同種異體iNKT細胞、現貨型CAR-iNKT細胞、iPSC-iNKT細胞產品在臨床前階段。
國外iNKT細胞療法在研廠商
- Mink Therapeutics
Mink Therapeutics旗下的在研產品管線,包括1款進入臨床I/II期的iNKT細胞治療產品和4款處於臨床前研究階段的CAR-iNKT細胞治療產品。
2023年4月,公司發佈針對實體瘤治療的同種異體iNKT細胞(AGENT-797)的臨床數據,結果顯示,AGENT-797單獨給藥或與抗PD-1治療聯合使用,在難治性實體瘤患者中顯示出活性。對帕博利珠單抗和納武利尤單抗/FOLFOX治療無反應的轉移性胃癌患者中,腫瘤縮小率為42%,且持續時間超過9個月。
- Kite & Appia Bio.
吉利德旗下的Kite和Appia Bio共同基於Appia Bio的ACUA 技術平台進行開發,利用工程化造血幹細胞(HSC)生成CAR-iNKT,用於同種異體細胞治療。目前,兩款源於HSC的CAR-iNKT候選療法處於臨床前階段,適應症為血液癌症。Appia Bio負責兩種由Kite提供的CARs改造的HSC衍生CAR-iNKT候選產品的臨床前和早期臨床研究。Kite負責提供工程嵌合抗原受體、後續開發、生產和商業化。
- Arovella Therapeutics
Arovella Therapeutics旗下有4款CAR-iNKT產品管線,目前均處於臨床前階段。
2023年4月,在美國癌症研究協會(AACR)年會上公佈ALA-101的最新研究進展。結果顯示,ALA-101有效殺死表達 CD19 的腫瘤細胞,且在制造過程中細胞數量擴增超過5,000倍,還證明了冷凍後細胞保持效力。此外,Arovella已與Imugene達成戰略合作,Arovella的細胞治療項目CAR19-iNKT(ALA-101)與Imugene的onCARlytics(CF33-CD19)平台共同開發治療實體瘤的產品。
除了iNKT細胞之外,全球有多家研發廠商佈局基於NKT細胞的免疫療法領域,例如精準生技、Brightpath Bio.、Athenex (Kuur Therapeutics),且臨床進展主要集中在臨床前和臨床I期階段。
國内外NKT細胞療法在研廠商
- 精準生技
精準生技旗下的NK/NKT細胞療法產品(PB-101)被開發用於治療EGFR突變晚期非小細胞肺癌患者,目前臨床I期試驗正在進行中,將評估EGFR-TKI標準治療聯合PB-101細胞療法的安全性和耐受性。
- Immunisbio
Immunisbio正在開發的自體產品管線MYJ-1633含有NK細胞和NKT細胞,目前正在進行臨床I期試驗,將評估MYJ-1633作為三線療法治療復發性和難治性胃癌患者的安全性和有效性。
- Brightpath Bio.
Brightpath旗下正在研發的一款同種異體CAR-NKT細胞治療產品(BP2201),NKT細胞由誘導多能幹細胞(iPSC)衍生而來。目前,由研究者發起的頭頸癌患者iPS-NKT的I期試驗正在千葉大學進行,也是iPSC來源的NKT細胞在細胞治療中的首次臨床應用。
- Athenex (Kuur Therapeutics)
Athenex收購細胞療法公司Kuur Therapeutics,旗下正在開發3款CAR-NKT細胞免疫療法,包括CMD-501、KUR-502、KUR-503,用於實體瘤和血液瘤治療領域,以及1款TCR-NKT細胞產品,用於治療基因驅動的上皮癌。
2022年1月,Athenex公佈了CMD-501和KUR-502的臨床I期數據。CMD-501是一種靶向GD2的同種自體CAR-NKT療法,用於治療復發/難治(R/R)高風險神經母細胞瘤。I期GINAKIT2研究結果顯示,10例可評估患者中,出現1例完全緩解和1例部分緩解,3例患者疾病穩定。腫瘤活檢顯示,所有劑量組的CAR-NKT細胞均有遷移至腫瘤位置。在安全性方面,顯示總體良好,有1例2級細胞因子綜合症(CRS),未出現免疫效應器細胞相關神經毒性綜合徵(ICANS)。KUR-502一種靶向CD19的同種異體CAR-NKT細胞治療產品,用於治療復發、難治性CD19陽性淋巴瘤和白血病,I期ANCHOR研究的中期數據顯示客觀緩解率達57%,後續將進一步研究其臨床安全性、治療活性、細胞擴散情況等。
- CytoMed Therapeutics
CytoMed通過結合iPSC技術和定向分化技術,生成一種新型的合成免疫細胞,即γδNKT細胞,表達來自iPSC的γδT細胞和NK細胞的癌症識别受體。目前公司針對實體瘤開發的在研管線GDNKT已經完成前期的概念驗證,目前處於臨床前研究階段。
近年來,iNKT細胞在腫瘤免疫中的基礎研究和臨床應用上取得了顯著進展,不斷刷新行業的認知和期待。展望未來,隨著更多研發企業投身於iNKT細胞領域的研究,臨床試驗研究陸續開展,以進一步驗證其潛在的臨床價值,iNKT細胞療法或將為腫瘤的治療提供新的方向,助力於改善以往惡性腫瘤治療困境,有望逆轉患者免疫功能低下,維持患者機體良好的抗腫瘤免疫功能。隨著iNKT細胞研究的不斷深入和在臨床上的廣泛應用,將革新腫瘤細胞免疫治療領域的整體格局。
