文章來源:弗若斯特沙利文公眾號
CAR-T療法已在B細胞系淋巴瘤/白血病等表現出優異的治療效果,但T細胞來源的淋巴瘤/白血病等疾病的主要治療手段仍為化療,臨床療效存在一定局限,亟待創新治療方案。鑒於CD7抗原在T-ALL等惡性腫瘤細胞表面廣泛表達,針對該靶點的CAR-T細胞療法成為T細胞系淋巴瘤/白血病的重要研究方向,有望進一步拓展CAR-T療法價值。
1. CAR-T細胞療法賽道火熱,為腫瘤治療帶來新希望
- CAR-T療法商業化加速,產品營收矚目
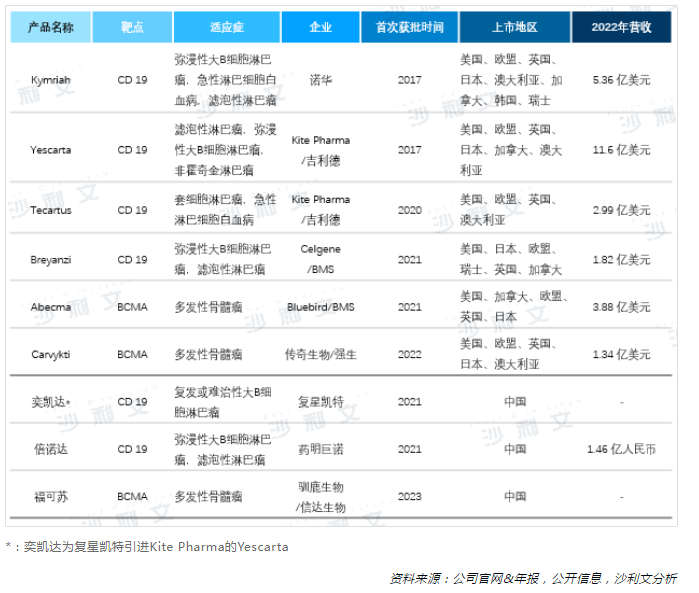
2017年,美國FDA相繼批準諾華的Kymriah和吉利德的Yescarta上市,CAR-T產品正式登上歷史舞台,並憑借其在淋巴瘤和白血病中矚目的治療效果,快速在多個國家或地區獲批。在中國市場,2021年NMPA先後批準奕凱達和倍諾達兩款CD19靶點CAR-T產品,2023年BCMA靶點產品福可蘇成功上市,為我國血液瘤患者提供了新的治療選擇。截至2023年10月,海外已有6款CAR-T產品獲批上市,靶點分别是CD19(4款)和BCMA(2款);國内已有3款CAR-T產品上市,其中2款靶向CD19、1款靶向BCMA。
已上市的CAR-T產品營收保持增長態勢,根據公司年報及官網信息披露,2022年Yescarta以11.6億美元穩居CAR-T產品營收第一,Abecma也達到3.88億美元。我國上市的CAR-T產品倍諾達在2022年實現了1.46億人民幣的營收,較2021年的3,080萬增長374%,放量加速。
- CAR-T療法優勢顯著,為患者帶來治愈希望
嵌合抗原受體(CAR)主要由細胞外單鏈抗體、跨膜區和胞内信號結構域組成。嵌合抗原受體T細胞(CAR-T)通過膜表達的嵌合抗原受體來靶向捕捉癌細胞表面抗原,結合成功後,CAR-T細胞通過釋放細胞因子、穿孔素等對癌細胞進行靶向摧毀。該療法還可形成記憶CAR-T細胞,為病人提供抗腫瘤的長效機制,有效延長了病人的生存率,甚至可能達到治愈效果。

- CAR-T市場規模快速擴大,前景廣闊
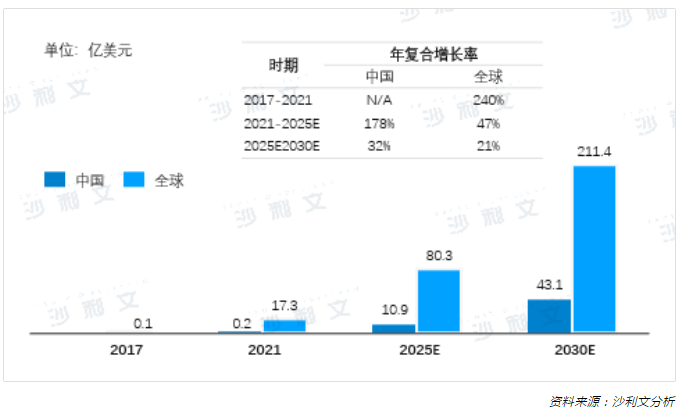
自2017年兩款CAR-T產品獲得上市批準,為惡性血液腫瘤患者帶來了希望,市場規模持續穩定增長。據沙利文分析,全球CAR-T市場從2017年的約0.1億美元迅速增長到2021年的17.3億美元,2021~2025年預計將以47%的CAGR增長到80.3億美元,並將以21%的CAGR增長到2030年的211.4億美元。
雖然CAR-T於2021年才在中國獲批上市,但市場規模快速增長,預計將從2021年的0.2億美元以178%的CAGR增長到2025年的10.9億美元,並於2030年將達到43.1億美元,未來市場潛力巨大。
- CAR-T賽道研發加速,適應症持續拓展
中國CAR-T研發實力強勁,有望在全球細胞治療領域領跑。CDE官網顯示,三款國内自主研發的CAR-T處於BLA審批中:科濟藥業的澤沃基奧侖賽和傳奇生物的西達基奧侖賽,靶點均為BCMA,適應症為復發性/難治性多發性骨髓瘤(R/RMM);合源生物的赫基侖賽(暫定)靶向CD19,適應症為人復發或難治性B細胞型急性淋巴細胞白血病(R/R B-ALL)。
此外,復星凱特已上市CAR-T產品奕凱達於2023年6月獲批新適應症:一線免疫化療無效或在一線免疫化療後12個月内復發的成人大B細胞淋巴瘤。該二線治療適應症的獲批不僅給淋巴瘤患者治療帶來了新進展,更標志著CAR-T產品適應症成功從末線向前線拓展,臨床適用患者群體不斷擴大。
CD19、BCMA作為熱門靶點,適應症集中在B細胞淋巴瘤/白血病和多發性骨髓瘤。根據CDE數據,截至2023年10月,CD19靶點CAR-T臨床試驗有54項、BCMA靶點CAR-T有11項。但腫瘤治療領域仍有大量未滿足的臨床需求,隨著CAR-T研發的深入,針對CD7、B7-H3、CLDN18.2等新靶點CAR-T療法有望為更多血液病和實體瘤患者帶來新的治療選擇。
2. 前體淋巴瘤/白血病患病群體持續增長,疾病負擔沉重
- 前體淋巴瘤/白血病侵襲性高,疾病負擔沉重
前體淋巴細胞腫瘤(Precursor lymphoid Neoplasms)是前體淋巴細胞異常增生引起的惡性腫瘤,大部分患者可檢測出克隆性染色體異常。根據2022年發佈的《The 5th edition of the WHO Classification of Hematolymphoid Tumors》,前體淋巴瘤分為B淋巴母細胞白血病/淋巴瘤(B-ALL/LBL)、T淋巴母細胞白血病/淋巴瘤(T-ALL/LBL)。ALL和LBL有相似的臨床和實驗室特徵(細胞形態學、免疫表型、基因型、細胞遺傳學、臨床表現和預後等),但臨床特點有差異,通常將以髓外病變為主要表現的歸類為LBL,而將以外周血和骨髓廣泛受侵為主要表現的歸類為ALL。
T-ALL/LBL疾病負擔沉重,其中T-ALL分别佔兒童和成人ALL的15%和25%,多具有外周血高白細胞計數、器官浸潤和中樞神經系統侵犯等不良預後因素;T-LBL佔LBL的80%以上,具有高度侵襲性。
- 前體淋巴瘤現有治療手段效果不理想,患者對新療法需求迫切
(1)一線治療藥物有限且療效不理想
前體淋巴瘤/白血病一線治療藥物主要為化療藥物,但早期化療存在耐藥風險,現有治療方案療效仍不夠理想。同時,成人LBL預後差於兒童,不良預後因素包括CNS受累、誘導化療結束後有殘存病變等。
(2)復發性T-ALL無統一救治標準
T-ALL復發多為早期復發(確診後2年内),佔整體復發人群的80%。復發後患者預後極差,5年OS率僅為10%,T-ALL患者復發後再次達CR的比例明顯降低。復發性T-ALL尚無統一救治標準,多只能選擇臨床試驗、強化療等,單純傳統化療通常療效不佳。2005年FDA批準奈拉濱用於治療至少兩種方案無效或復發的T-ALL,單藥治療復發T-ALL成年患者總反應率為41%~46%、兒童55%,應用奈拉濱再誘導治療獲得二次緩解後行allo-HSCT的1年、6年OS分别為24%、11%,治療效果仍不理想,且奈拉濱目前尚未在我國獲批上市,中國復發性T-ALL患者存在迫切的未被滿足的臨床需求。
(3)復發或難治性T-LBL缺乏有效治療手段
根據《中國淋巴瘤治療指南(2021年版)》,初治高危和復發或難治性的患者,建議可選擇參加合適的臨床試驗等,有條件的患者可考慮allo-SCT,對新的治療手段存在巨大臨床需求。
3. CD7靶點CAR-T療法脫穎而出,挑戰與機遇並存
- 聚焦新靶點,CD7靶向CAR-T療法優勢顯著
CD7是一種單鏈跨膜糖蛋白,表達在T細胞和NK細胞及其前體細胞膜表面。在淋巴細胞發育過程中,CD7是T、B淋巴細胞相互作用的共刺激受體。
臨床研究發現,CD7分子高表達於T-ALL細胞、T-LBL細胞,約30% AML患者的腫瘤細胞上亦可檢測到CD7分子,此外未分化白血病細胞及白血病幹細胞(LSC)也被證實存在CD7分子表達。雖然正常T細胞也表達CD7,但在外周血中還同時存在一群CD7陰性的T細胞,因此採用CD7-CAR-T殺傷腫瘤後,這群細胞可以維持人體正常免疫功能,同時,CD7缺失對T細胞的正常發育成熟及人體穩態幾乎不產生影響,所以CD7是CAR-T治療具有較好安全優勢的一個靶點。
- CD7靶向CAR-T早期臨床試驗數據透露積極信號
Zhang M等人[1]開展的I期臨床試驗數據顯示,T-ALL/LBL患者注射自體CD7靶向CAR-T藥物後3個月CR率為87.5%,其中1例T-ALL患者達到了微小殘留病竈陰性的CR,1例T-LBL患者CR超過12個月;87.5%患者只有1~2級細胞因子釋放綜合徵(CRS),未觀察到T細胞發育不全或神經毒性。Lu P等人[2]開展的CD7靶點CAR-T治療20例R/R T-ALL/LBL患者I期臨床試驗結果顯示,19名患者在用藥後28天達到骨髓微小殘留病竈陰性的CR;中位隨訪時間142.5天,14位後續接受異體造血幹細胞移植患者無復發;僅1例發生3級CRS。
- 技術壁壘高,CD7靶向CAR-T研發面臨挑戰
(1)CAR-T「自殺傷」現象
CAR靶抗原(CD7)在CAR-T細胞表面的表達導致CAR-T細胞發生「自殺傷」情況,CAR-T細胞被清除,使CAR-T細胞在患者體内擴散有限、殺瘤效果不理想。針對該問題,Wugen Therapeutics和Beam Therapeutics為代表的企業,主要通過基因編輯或者堿基編輯技術敲除CAR-T細胞的CD7基因來解決「自殺傷」問題;博生吉則通過非基因編輯策略,只對CD7蛋白進行了内質網滞留處理,沒有對基因組進行任何插入,具有潛在安全性優勢。
(2)分離惡性與正常T細胞
在制造細胞產品的過程中,若使用T細胞惡性腫瘤患者自身的T細胞制備CAR-T產品,將面臨進一步從含有惡性T的細胞中分離出正常T細胞的挑戰。使用健康供者來源的T細胞進行CAR-T制備成為潛在解決方案,但也面臨移植物抗宿主病(GVHD)等問題。利用基因編輯工具改進CAR-T、使用γδT細胞作為CAR-T的細胞源等手段成為解決通用型CAR-T療法存在GVHD問題的重要潛在思路。
(3)消除對正常T細胞的毒性
患者體内正常T細胞也表達靶抗原,導致CAR-T細胞也會識别並殺傷正常T細胞。但由於部分外周正常T細胞天然不表達CD7,使得On-target、Off-tumor這一潛在的副作用在患者可耐受的範圍之内。
- CD7靶點CAR-T潛力巨大,或成為多種血液瘤新治療手段
由於EBV感染,在中國結外NK/T細胞淋巴瘤,鼻型(ENKL)和外周T淋巴瘤,非特指型(PTCL-NOS)是最常見的外周T細胞淋巴瘤(peripheral T-cell lymphoma,PTCL)亞型[3]。PTCL發病率佔非霍奇金淋巴瘤的25%~30%[4],一線治療方案主要為CHOP(環磷酰胺+多柔比星+長春新堿+潑尼松)等化療方案,但療效較差,5年生存率約30%,造血幹細胞移植可改善部分患者的長期預後,但仍面臨化療效果不理想、患者無法接受造血幹細胞移植等諸多臨床困境。
在全球範圍内,急性髓系白血病(AML)每年可造成超8萬人死亡,並預計這一數字將在20年後翻一倍[5]。《中國成人急性髓系白血病(非急性早幼粒細胞白血病)診療指南(2021年版)》推薦所有AML患者在能夠參加臨床研究的情況下首選參加臨床研究,缺乏臨床研究條件的採用化療方案。AML患者預後差,長期生存率低,年齡<60歲的患者長期生存率為35%~45%,年齡≥60歲的患者長期生存率僅為10%~15%[6]。
鑒於CD7分子在T淋巴瘤細胞高表達,並在約30% AML患者的白血病細胞上可檢測,因此靶向CD7的CAR-T療法對於PTCL、NKT淋巴瘤和AML也具有重要潛在治療價值。
4. CD7靶點CAR-T產品研發公司分析
- 行業玩家概覽
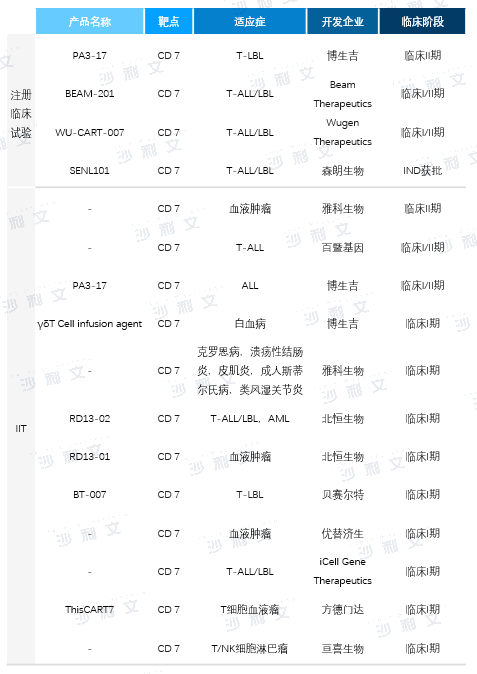
CD7靶點CAR-T療法技術壁壘高,目前佈局該領域的公司較少。據ClinicalTrials數據,截至2023年9月8日,按適應症拆分全球共有16條CD7靶點CAR-T在研管線,其中4條為注冊臨床試驗,12條為研究者發起的臨床試驗(IIT)。國内CDE注冊臨床試驗僅2項,其中博生吉PA3-17產品於2021年8月獲批IND,是全球首款獲批注冊臨床試驗的自體CD7-CAR-T產品,現已進入臨床II期,適應症為復發/難治性T-ALL/LBL;森朗生物SENL101產品於2023年6月獲批IND,適應症為復發/難治性T-ALL/LBL。此外,雅科生物、北恒生物、亘喜生物等其他中國公司也佈局了CD7靶點CAR-T產品管線,均為IIT。
- 引領CD7靶點CAR-T研發,博生吉CAR-T產品優勢顯著
在研CD7靶點CAR-T產品中,博生吉與Wugen Therapeutics已有相關注冊臨床試驗數據披露。
PA3-17注射液為博生吉創新自研的自體CD7-CAR-T產品。該產品瞄準R/R T-ALL/LBL,創新採用非基因編輯策略和納米抗體VHH6,獲取患者自身的外周血正常T淋巴細胞進行CAR改造,然後回輸至患者體内,避免了GVHD相關風險。PA3-17注射液優勢顯著,於2021年8月在中國獲批IND,是全球最早獲批IND的自體CD7-CAR-T產品。該產品於2021年、2022年先後獲美國FDA、歐盟孤兒藥認定,目前已進入臨床II期。
截至2023年10月15日,PA3-17注射液的注冊性臨床I期已完成11例R/R T-ALL/LBL患者評估,其中最佳客觀緩解率(ORR)為82%(9/11),最佳CR率為82%(9/11),mDOR及mPFS尚未達到。
Wugen Therapeutics[7]的WU-CART-007為CRISPR/Cas9基因編輯靶向CD7產品,正在開展治療R/R T-ALL/LBL臨床I/II期試驗。截至2023年1月30日,已有12例患者入組,≥DL2劑量患者療效數據顯示,ORR為43%(3/7),CR僅1例;25%患者出現3級及以上不良反應;67%患者出現CRS,其中1例為3級;1例患者出現1級免疫效應細胞相關神經毒性綜合徵(ICANS)。截止報道之日,Wugen公司觀察到的DOR僅為86天。
- 兼具一流細胞治療技術和生產基地,博生吉助力CAR-T治療再登新峰
博生吉公司擁有強大的自主研發能力,配備完善的細胞治療和分子生物學實驗室,可開展國際一流水平的細胞治療新技術的研發及生產,涵蓋抗原結合域的開發、CAR結構的優化、CAR-T細胞的功能測試、體内藥效試驗的驗證,以及完整的CAR-T細胞制備的全鏈條生產體系。
(1)自建創新研發平台
公司擁有多個先進技術平台,包括Safe UCAR-γδT平台、CAR結構及功能驗證平台、全自動CAR-T制備平台、CAR-T體内藥效驗證平台、懸浮慢病毒載體平台以及NanoBa雙特異抗體研發平台,強大自主研發能力為創新產品保駕護航。
(2)構建細胞治療網絡
公司以惡性腫瘤為抓手,已有兩款在研產品開展注冊臨床試驗,分别為治療R/R T-ALL/LBL的CD7靶點CAR-T產品PA3-17注射液,治療R/R神經母細胞瘤的B7-H3靶點的CAR-T產品TAA06注射液。此外,公司加速γδT通用型細胞治療產品研發,並已佈局自身免疫性疾病、衰老相關疾病等領域,多管齊下構建細胞治療網絡。
(3)坐擁亞太區最大規模CAR-T生產基地
2022年,公司建成1萬平方米符合GMP標準的商業化生產基地並投入使用。該基地建有國際一流水平CAR-T細胞制備車間、質粒與慢病毒GMP生產與純化車間、P2安全實驗室以及裝備先進的質量控制實驗室與研發實驗室,擁有完整的從質粒、慢病毒,一直到CAR-T細胞制備的全鏈條生產體系。
以CD7為靶點的CAR-T療法臨床試驗正加速推進中,II期臨床試驗的開展將進一步驗證其治療價值。未來,我國自主研發CD7靶點CAR-T療法有望在全球首批上市,將引領世界細胞治療,為更多的血液病患者帶來新希望。
