2018年4月,武田制藥以650億美元收購罕見病巨頭公司夏爾;2020年12月,阿斯利康以390億美元收購罕見病巨頭公司Alexion;2021年10月,默沙東將以110億美元(折合人民幣超700億元)收購制藥公司Acceleron......放眼全球,“罕見病”這塊曾經的創新藥“無人區”,正不斷迎來開拓大軍。
然而國內市場要想在罕見病高值藥物的可及、可負擔性方面實現路徑上的突破,國産罕見病研發企業的深度參與不可或缺。這也正是北海康成-B(01228)受到港股市場高度關注的原因之一。
智通財經APP了解到,近日北海康成更新招股書,正式進入招股階段。招股書顯示,公司于2021年11月30日至12月3日招股,全球發售總計5625.1萬股,其中香港公開發售562.6萬股,占10%;國際發售5062.5萬股,占90%。發售價每股12.18港元,公司預計12月10日正式挂牌上市。
身爲國內罕見藥治療行業的“獨角獸”,北海康成上市獲得了業界和資本市場的雙重期待。此次北海康成港股IPO,共吸引了6名基石投資者認購,其中包括RA Capital、Janus Investors、General Atlantic、Hudson Bay、瑞華資本以及藥明生物等在內的多家生物科技領域的知名企業和國際頂級長線投資基金。基石投資金額達到6000萬美元。
北海康成IPO來到招股階段,也就意味着打新通道的開啓。對于投資者而言,從政策、市場以及企業內在價值等角度切入,認識到公司核心研發管線背後的商業價值,便是此次打新北海康成最主要的邏輯。
罕見病迎來政策、市場加速度
如今,罕見病治療市場在跨國巨頭爭相湧入,國內政策壁壘逐漸攻破的背景下已然炙手可熱。但由于港股生物醫藥板塊缺乏相關標的,以致投資者無法觸及正在高速發展的罕見病治療賽道。如今,北海康成登陸港股在即,在填補當前港市在罕見病治療標的上投資空白的同時,還爲投資者提供了投資該賽道的機會。
全球罕見病治療市場的規模成長確定性體現在其市場空間以及市場活躍度上。
在市場空間方面,罕見病治療産業的市場潛力巨大。據Evaluate Pharma統計,全球已被獲知的罕見病超過7000種,但其中僅有5%有FDA批准的用藥。
市場規模來看,2016年全球罕見病藥市場規模爲1090億美元,2020年已增至1351億美元,預計2025年將達到2430億美元的規模,2030年將進一步增至3833億美元。這也讓罕見病已經成爲超越腫瘤、皮膚、神經、糖尿病等疾病的全球增長最快的領域。
而在市場活躍度方面,除了上文提到的衆多國際跨國藥企爭相通過並購等方式入局罕見病研發領域外,也顯示在其研發項目增速以及研發成功率上。
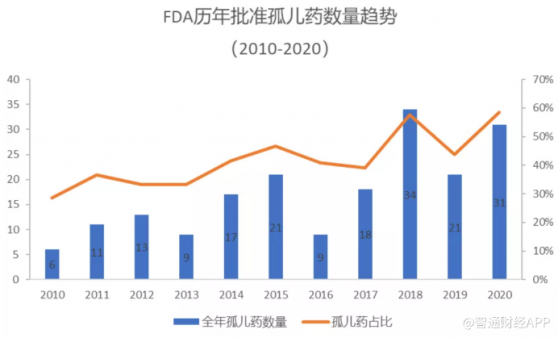
據塔夫茨大學藥品研發研究中心統計,2015年罕見病用藥臨床試驗數共766個,到2018年增長爲942個,年增長率8.9%。這一點也在美國FDA批准的新藥中得到了驗證。
據統計,從2010-2020年期間,FDA批准的孤兒藥數量呈現了穩步上升的趨勢。2010年,FDA批准的孤兒藥數量僅有6個,而這一數值到2018年已達到了34個。在2020年,FDA批准的孤兒藥數量爲31個,占全年獲批新藥總數的58.5%,比值達到了10年來的新高。這從側面預示着對罕見病用藥研發投入正逐見成效。
而在研發成功率方面,根據最新發布的一份藥物臨床開發成功率報告統計數據,在2011年-2020年,罕見病(不含腫瘤適應症)藥物從1期臨床到獲得美國FDA批准上市的平均成功率爲17.0%,高于整體藥物的平均開發成功率7.9%,且罕見病藥物四個開發階段轉化成功率均高于行業平均值。
然而回到中國市場,過去很長時間,考慮到政策、市場支付等原因,罕見病領域,無論是投資項目還是本土生物藥企都不多見,國內罕見病市場供需存在巨大的不匹配。
從市場來看,對標全球市場,中國罕見病市場的未來發展空間同樣十分廣闊。2016年,國內罕見病市場規模約爲5億美元左右,2020年超過13億美元,占全球比例大概是1%。預計到2030年,中國罕見病市場規模預計能達到259億美元(折合人民幣1665.42億元),屆時在全球市場規模中占比將達到約6.8%,增長潛力巨大。
爲解決國內龐大的未滿足罕見病治療需求,在國內藥政改革的穩步推進,新藥審評審批不斷加速的背景下,罕見病市場正迎來政策加速度。
據智通財經APP了解,從2018年制定《第一批罕見病目錄》,2019年國家衛建委發布《關于建立全國罕見病診療協作網的通知》;到2020年3月,國務院發布《關于深化醫療保障制度改革的意見》,將罕見病用藥保障寫入其中;再到2021年9月11日,《中國罕見病定義研究報告2021》首次提出“中國罕見病2021年版定義”。2021年10月11日,國家藥監局藥品審評中心正式發布了關于公開征求《罕見疾病藥物臨床研發技術指導原則》意見的通知,旨在進一步提高罕見疾病臨床研發效率,滿足罕見疾病患者的治療需求。隨着近兩年我們對罕見病的認識不斷加深以及國家政策的大力扶持,國內罕見病治療格局正悄然改變。
特別是中國加入ICH後,各類標准已經與國際接軌。曆年醫保談判都有罕見病藥物納入醫保目錄,下至地方也都在積極探索不同的罕見病保障模式,國內罕見病領域長期發展帶來新窗口,進一步增強了國內罕見病治療賽道的成長確定性,也爲以北海康成爲代表的國內本土罕見病治療研發企業帶來了政策和市場紅利。
罕見病治療賽道“獨角獸”
投資生物醫藥行業的特點在于其版圖的豐富性,一個適應症就是一個賽道,每個賽道都具有特定的壁壘。這一特性在罕見病治療領域顯得格外突出。
北海康成之所以值得期待,便在于其獨特且確定性較強的罕見病治療研發管線,這也是公司內在價值不斷釋放的重要根基。
如上文提到的,全球罕見病治療市場廣闊,將在2030年達到近4000億美元的龐大規模,涵蓋罕見病適應症的各個賽道。但在全球研發領域,各大Big Pharma卻依然選擇紮堆血友病等主要賽道。在跨國藥企的罕見病布局版圖中,血友病屬于非常熱門的賽道。當前包括羅氏、輝瑞、拜耳、賽諾菲及武田制藥等多家國際知名藥企均在A型血友病領域投入大量研發,賽道擁擠可見一斑。
而與此同時,一些冷門賽道依然鮮有關注。以MPS II (又稱亨特綜合征)爲例,MPS II是一種罕見的、可致殘甚至導致死亡的遺傳性疾病,收錄于中國《第一批罕見病目錄》。
其適應症的患病原因爲,患者溶酶體酶中的IDS缺失或缺乏,導致體內的兩種黏多糖無法降解代謝而逐漸積聚,並隨尿排出。隨着沉積的增多,引起組織功能障礙、器官衰竭和患者預期壽命縮短。臨床表現爲發育遲緩、面容粗陋、多發性骨骼畸形、關節攣縮、疝氣、肝脾腫大、聽力喪失、心髒瓣膜病、肥厚型心肌病、阻塞性睡眠呼吸暫停以及限制性肺病等。
該病屬于伴性隱性遺傳,患病者均爲男性,患病率爲1.3/10萬新生男孩。重型MPS II患者最多可以存活10年至20年,輕型患者通常可以存活到中年。
據2020年5月發布的《從黏多糖貯積症剖析中國罕見病患者生存現狀》報告稱,由于國內缺乏有效的酶替代治療藥物,41%的黏多糖貯積症患者在確診後未接受任何治療,47%的患者只能對症治療,甚至有8.95%的患者爲了接受有效藥物的治療而遠走海外。
然而在國外,患者唯一可使用藥物是由Shire生産的Elaprase®(Idursulfase)。該藥于2006年7月通過FDA批准上市,于2007年8月獲歐盟批准上市。值得一提的是,它是有史以來生産的最昂貴的藥物之一,平均每位患者每年花費56萬余美元。2020年Elaprase的全球銷售額高達6.29億美金。
這一市場背景也正反映出北海康成的稀缺性。北海康成之所以被稱爲罕見病治療領域的“獨角獸”,便在于其獨特的管線布局以及極高的成長屬性。
據智通財經APP了解,Hunterase®(CAN101)作爲北海康成的重磅産品,已于去年9月在中國獲批上市,用于治療黏多糖貯積症Ⅱ型(MPSⅡ,亨特綜合征)。
這是北海康成在中國成功商業化的第一款罕見病藥物,也是國內首個且唯一的全球新一代治療MPSⅡ的酶替代療法(Enzyme replacement therapy,ERT),擁有FDA孤兒藥資格認證,且在此前獲得國家藥監局的優先審評資格,填補了我國在MPSⅡ適應症臨床治療領域的空白。
從市場競爭格局來看,由于Hunterase®是目前國內僅有可用的MPS II靶向療法,因此面對逐漸增長的治療市場缺口,Hunterase®在商業化層面擁有獨占優勢,市場開發潛力較大。
實際上,Hunterase®只是北海康成在罕見病治療創新研發領域的一個縮影。除了Hunterase®外,北海康成還布局了靶向部分常見的罕見疾病以及罕見腫瘤適應症的罕見藥治療研發管線,建立起了一套包括生物制劑、小分子及基因療法解決方案在內的産品組合。
目前,北海康成針對具有市場潛力和經驗證作用機制的罕見病適應症,已開發了13種擁有巨大市場潛力的藥物資産組成的綜合差異化産品,其中包括3種已上市産品、4種處于臨床階段的候選藥物、1個處于IND准備階段、2個處于臨床前階段以及3個處于先導識別階段的基因療法産品。
在罕見病研發管線方面,北海康成擁有7種生物制劑及小分子産品候選産品,對應適應症包括亨特氏綜合症(MPS II)及其他溶酶體貯積病(LSD)、補體介導紊亂、A型血友病、代謝紊亂,以及罕見膽汁淤積性肝病,包括Alagille綜合症(ALGS)、進行性家族性肝內膽汁淤積症(PFIC)及膽道閉鎖(BA)。
最新的研發進展顯示,今年7月,公司用于治療陣發性睡眠性血紅蛋白尿症的CAN106注射液正式獲批臨床;同年10月,關于治療戈謝病的CAN103項目臨床試驗申請(IND)的正式獲批。
以CAN106爲例,該産品是一種作用于補體系統C5靶點的長效人單克隆抗體,用于治療陣發性睡眠性血紅蛋白尿症(PNH)。該適應症是一種由于體細胞xp22.1上PIG-A基因突變導致補體系統失調的罕見獲得性造血幹細胞克隆性疾病。其臨床表現以血管內溶血性貧血爲主,可伴有血栓、腎功能不全、肺動脈高壓等症狀,在2018年被中國列入《第一批罕見病目錄》。
從適應症市場來看,自2016年至2020年,中國PNH的患病率由2.33萬人增加至2.38萬人,預計在2030年達到2.45萬人。同期,PNH在世界其他地區的患病率由9.58萬人增加至10.05萬人,預期于2030年將達到11.18萬人。
從全球市場競爭格局來看,目前全球獲批治療PNH的補體C5抑制劑藥物僅有Soliris(Eculizumab)和Ultomiris(Ravulizumab),這兩款藥物均由美國公司Alexion開發,該公司目前市值已達403億美元,折合人民幣2580億元。
且值得一提的是,Soliris治療費用高昂,每位患者每年耗費約爲50萬美元。在此背景下,國內市場迫切需要更具成本效益的療法,國産替代需求巨大,也爲CAN106未來上市提供了良好的市場基礎。
並且,據Alexion公司財報2020年Soliris 和Ultomoiris 的銷售額達到52.9億美金;Soliris和Ultomiris可成爲銷售總額破10億美元的重磅産品,可見PNH適應症市場潛力巨大。待CAN106上市後,或爲北海康成打開豐厚的利潤空間。
而在罕見腫瘤領域,北海康成的創新研發同樣在穩步推進。以CAN008爲例,該産品主要用于治療多形性膠質母細胞瘤(GBM),最新研發進展顯示,公司今年10月就GBM患者一線治療在中國內地進行CAN008的II期臨床試驗的首例患者給藥。此外,其他兩種腫瘤産品CaphosolTM(CAN002)和Nerlynx®(CAN030)也已分別在中國內地及大中華區獲得了上市許可。
值得一提的是,除了小分子和生物藥,北海康成正在積極布局下一代基因治療。基因治療對某些罕見遺傳病,是具有永久治愈可能的潛在療法。北海康成正在使用LogicBio Therapeutics授權的AAV sL65衣殼載體,開發兩種分別用于治療法布雷病和龐貝氏病的基因治療産品。
此外,北海康成與研究合作夥伴UMass合作開展贊助研究計劃,以開發神經肌肉疾病的基因治療解決方案,並獨家選擇許可用于開發的資産。公司還在內部開發針對不同組織的腺相關病毒(AAV)遞送平台,例如針對中樞神經系統(CNS)和肌肉。並且,爲擴大基因療法的發展規模,北海康成將建立內部工藝開發及制造基礎設施,在大波士頓地區建立的AAV工藝開發實驗室預計將于2022年開業。
綜上所述,北海康成現已建立了一套高效的創新研發體系,推動其罕見病治療管線全面推進。而從投資的角度來看,已獲衆多國際前沿投資機構青睐的北海康成上市起點較高,投資者可考慮打新或者長期持有。