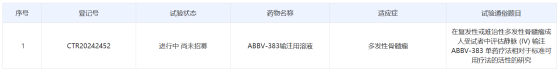
智通財經APP獲悉,中國藥物臨牀試驗登記與信息公示平臺官網近日公示,艾伯維公司(ABBV.US)在中國啓動了ABBV-383輸注用溶液的國際多中心(含中國)3期臨牀研究,針對適應症爲3線及以上覆發/難治性多發性骨髓瘤(RRMM)。公開資料顯示,ABBV-383是艾伯維臨牀管線中的一款靶向BCMA和CD3的雙特異性抗體。在該研究中,ABBV-383爲靜脈輸注,每4週一次。
ABBV-383是艾伯維在研的BCMA x CD3雙特異性抗體T細胞接合器,由雙價高親和力BCMA結合域、低親和力CD3結合域組成,旨在降低細胞因子釋放綜合徵(CRS)的風險。其還包含一個沉默的Fc尾部,旨在延長半衰期,可以支持每4周(Q4W)一次給藥,從而可以提高患者的便利性,減輕患者的治療負擔。
根據此前發表的數據,ABBV-383在復發/難治性多發性骨髓瘤患者的首次人體1期研究中獲得了安全性和有效性結果。數據顯示,在40mg和60mg劑量下,ABBV-383單藥治療產生了深度和持久的反應,中位無進展生存期(mPFS)分別爲13.7個月和11.2個月,12個月緩解持續時間(DOR)率分別爲70%和66%。此外60mg Q4W組患者的客觀緩解率(ORR)爲65%。除了針對多發性骨髓瘤,ABBV-383還有望用於治療免疫球蛋白輕鏈澱粉樣變,目前針對該適應症正處於1期臨牀研究中。