坐擁多款已商業化產品的信達生物(01801.HK)是國内生物科技領域内的佼佼者之一,並於前不久和百濟神州(06160.HK)、君實生物(01877.HK)等企業一起入選了第十屆港股100強之「生物科技股15強」子榜單。
3月6日,該公司又迎來了一個好消息。據悉,信達生物發佈消息稱,由禮來制藥(LLY.US)研發、公司負責中國商業化的口服RET酪氨酸激酶抑制劑產品睿妥®(塞普替尼)已於近日在中國正式商業化上市,自3月4日起向全國供藥。
3月7日早盤,信達生物的股價一度延續近日的升勢上漲近5%,不過此後或是受市場整體環境的影響,該股遭遇回落,截至收盤最終微跌0.47%;3月8日,在港股持續低迷的影響之下,信達生物股價表現不佳,截至發稿前,公司股價跌幅為3.31%。
塞普替尼開啓商業化,8款上市產品在手
信達生物成立於2011年,上市於2018年,公司致力於開發、生產和銷售用於治療腫瘤、代謝疾病、自身免疫等多個疾病領域的創新藥物。
據了解,此次正式商業化上市的塞普替尼是全球首款獲批的高選擇性RET抑制劑,通過抑制異常RET激酶的活性而發揮作用。塞普替尼已先後獲得美國FDA三項突破性療法認證和優先審評審批資格,並於2020年5月經美國FDA批準上市,用於治療轉染重排基因(RET)融合陽性的轉移性非小細胞肺癌的成年患者,和需要系統性治療的攜帶RET突變的晚期或轉移性甲狀腺髓樣癌成人和12歲及以上的兒童患者,以及需要系統性治療和放射性碘治療(如適用)難治的RET融合陽性的晚期或轉移性甲狀腺癌成人和12歲及以上的兒童患者。
2022年9月,FDA批準塞普替尼作為首個且唯一RET抑制劑,不限癌種用於RET基因融合的晚期或轉移性實體瘤成人患者,同時常規批準該藥用於RET融合陽性的局部晚期或轉移性非小細胞肺癌成人患者。
雖然該藥物由禮來制藥研發,但是負責在中國市場實現商業化的則是其合作夥伴信達生物。
2022年9月30日,國家藥品監督管理局附條件批準睿妥®在中國用於RET融合陽性的非小細胞肺癌、RET融合陽性的甲狀腺癌、RET突變型甲狀腺髓樣癌的治療。直到2023年3月4日,信達生物正式向全國供藥,這標志著RET變異非小細胞肺癌和甲狀腺癌患者迎來新的治療選擇。
據了解,睿妥®在已經上架銷售的部分藥店公開零售價(不考慮優惠贈藥等福利):80mg*56粒/1盒 32833.5元。
隨著塞普替尼的加入,信達生物商業化產品矩陣更加夯實。
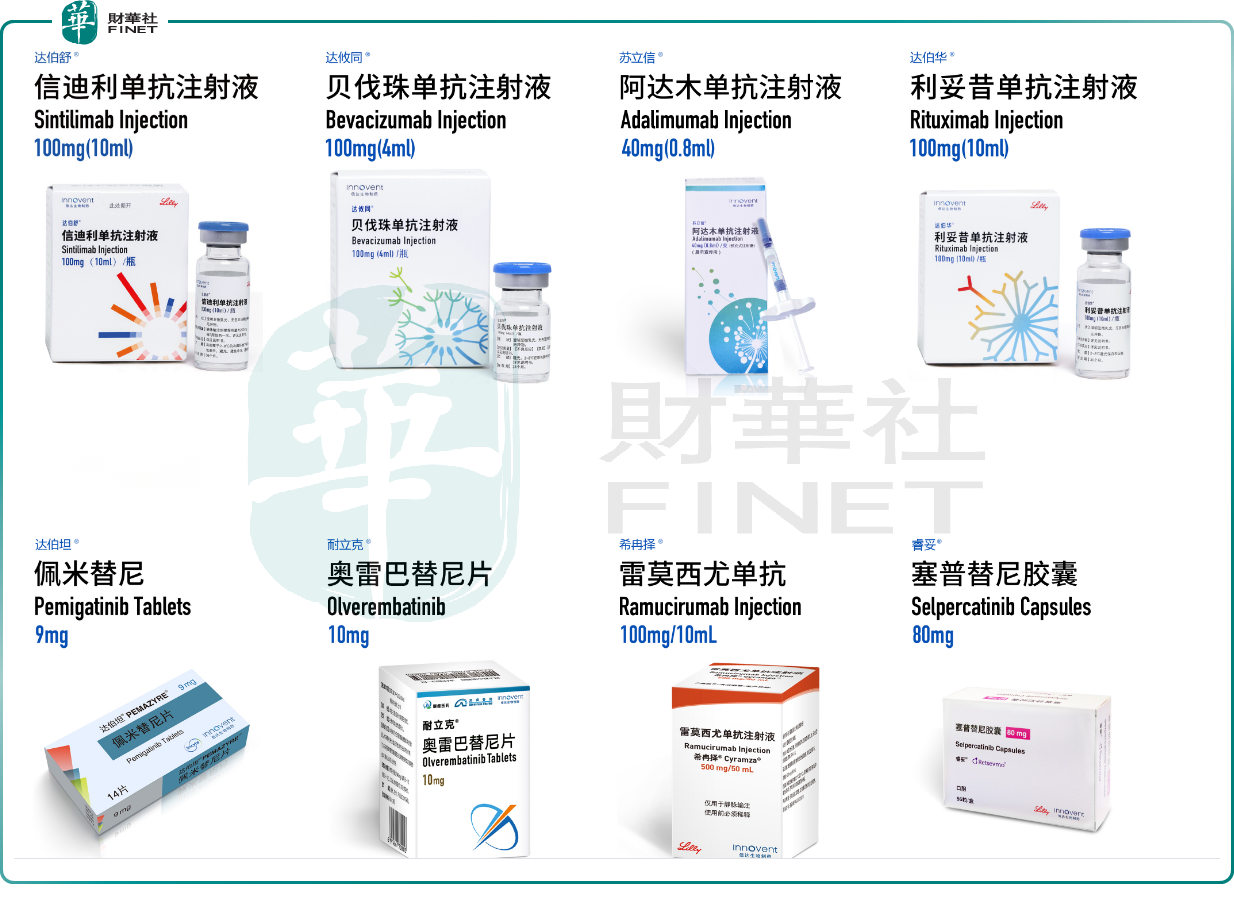
目前信達生物有8款商業化產品:信迪利單抗注射液(商品名:達伯舒®)、貝伐珠單抗生物類似藥(商品名:達攸同®)、阿達木單抗生物類似藥(商品名:蘇立信®)、利妥昔單抗生物類似藥(商品名:達伯華®)、pemigatinib口服抑制劑(商品名:達伯坦®)、奧雷巴替尼片(商品名:耐立克®)、雷莫西尤單抗(商品名:希冉擇®)以及塞普替尼膠囊(商品名:睿妥®)。
禮來為何選擇信達生物
至於禮來為何將重磅產品交給信達生物,而非國内產業鏈優勢更甚的藥企。了解信達生物發展史的財華社,回答這樣的疑問並不復雜。
抛開利益關系不講,從關系層面出發,信達生物與禮來是「老相好」,兩者最早的合作應該是在2015年。彼時,信達生物與禮來訂立中國獨家授權及合作協議和共同研發協議。其中開發及商業化活動所覆蓋的產品就包括信達生物的拳頭產品信迪利單抗。
之後,禮來與信達生物關系越走越近,兩者擦除不少愛的火花。據信達官網顯示,目前,在8款商業化產品中,有4款產品都與禮來有關系,產品包括信迪利單抗注射液(商品名:達伯舒®)、利妥昔單抗生物類似藥(商品名:達伯華®)、雷莫西尤單抗(商品名:希冉擇®)以及塞普替尼膠囊(商品名:睿妥®)。

產品商業化持續推進,營收迎來「狂飙」
值得注意的是,信達生物的第1款商業化產品信迪利單抗是於2019年推向市場,到如今第8款產品上市也不過4年時間,商業化進程速度其實相當得快,成績不俗。
在這個過程中,該公司的營收整體迎來了迅猛增長,其中由於信迪利單抗的上市,信達生物2019年的營收直接從前一年的947.7萬元(如非特指,以下元均指人民幣)增長到了10.48億元。
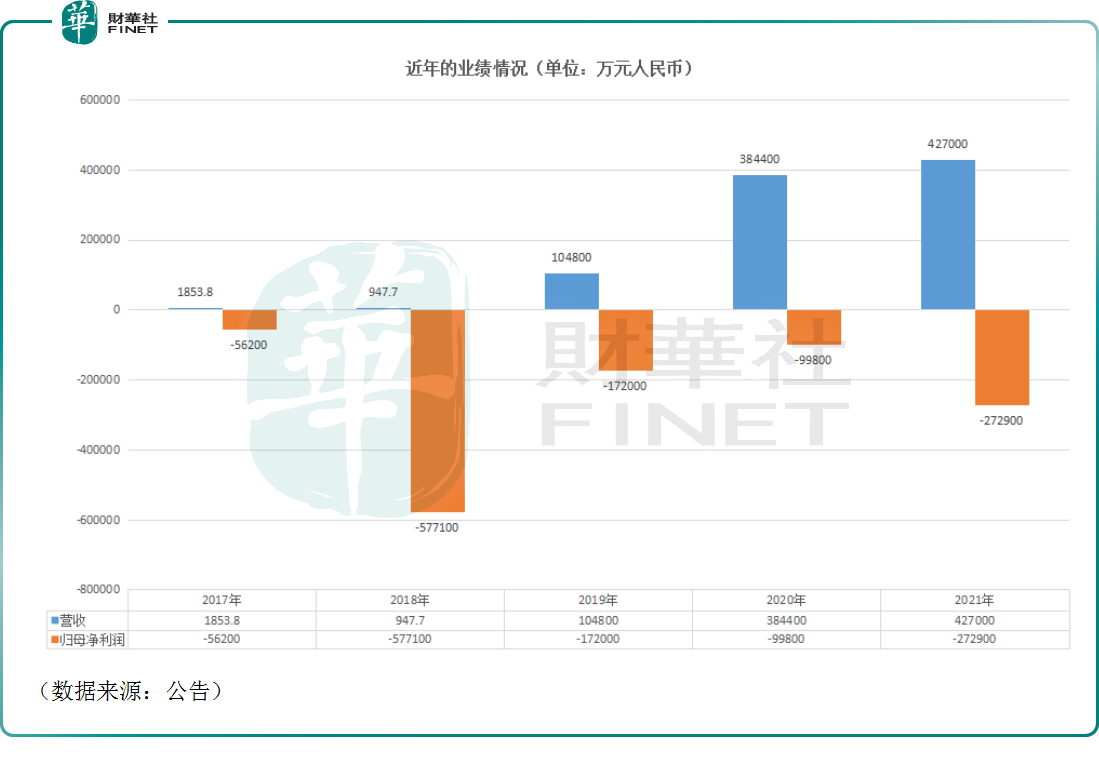
不過,雖然營收在一路走高,但是信達生物的歸母淨利潤卻一直在虧損,且2021年暴虧27.29億元也打破了此前三年虧損連續收窄的趨勢。這主要是持續地研發投入、銷售及市場推廣開支增加等因素導致。
2022年上半年,該公司實現營收22.4億元,同比增長15.34%。而在非國際財務報告準則計量下,信達生物期内的歸母淨利潤虧損10.85億元,較去年同期有所增加;在國際財務報告準則計量下,其上半年的歸母淨利潤虧損9.5億元,虧損同比減少5.29%。
總的來看,伴隨著產品商業化進程的推進,信達生物的營收的確在「狂飙」,但該公司距離盈利還有比較遠的距離。
前景被廣泛看好,新產品值得期待
即使一直未能盈利,但是作為國内創新藥企巨頭之一,信達生物也還是備受機構的青睐,其前景也被廣泛看好。
對於該公司來說,目前對於業績影響最大的就是第1款商業化產品信迪利單抗。
該款藥物是信達生物自主研發的創新生物藥,為全人源化的IgG4單克隆抗體,能特異性結合T細胞表面的PD-1分子,阻斷這條免疫逃逸通路,重新激活T細胞,釋放細胞因子殺傷腫瘤細胞。
官網顯示,2022年6月,信迪利單抗注射液第五項適應症一線食管鱗癌、第六項適應症一線胃及胃食管交界處腺癌在中國獲批,信迪利單抗成為唯一在五大高發瘤種一線治療均獲批的PD-1抑制劑,包括1L非鱗狀NSCLC、1L鱗狀NSCLC、1LHCC、1LESCC及1LGC。
此前信迪利單抗就曾納入醫保目錄,其中於2019年、2021年分别納入經典型霍奇金淋巴瘤二線治療和非鱗肺癌、鱗狀肺癌、肝細胞癌一線治療,涉及4種適應症。而到了最新醫保目錄,該款藥品再次新增腫瘤領域的2種醫保適應症範疇,且是在胃癌領域首個納入醫保目錄的PD-1類免疫治療藥物。
雖然因納入醫保,信迪利單抗的價格下降明顯,但產品銷量在快速增長。
浦銀國際此前曾發佈研報稱,國内PD-1/PD-L1後續滲透空間依然可觀,諸如信達等擁有先發優勢和強大商業化能力的公司仍將長期保持龍頭地位;預計信迪利的國内峰值銷售將達到56億元人民幣。
除了這款產品外,其餘一些產品也新增了多項新的適應症。例如,腫瘤藥達攸同新增原發性腹膜癌、宮頸癌及肝細胞癌三項適應症;腫瘤藥達伯華新增初治濾泡性淋巴瘤的維持治療和慢性淋巴細胞白血病兩項適應症;自身免疫類藥物蘇立信新增成人及兒童克羅恩病兩項新適應症。
隨著適應症範圍的擴大,這些藥物的銷量預期也將隨之增加。
而最新上市的塞普替尼主要針對的是RET變異非小細胞肺癌和甲狀腺癌領域。
在中國,肺癌的發病率和死亡率位居癌症之首。所有肺癌分型中有80%-85%屬於非小細胞肺癌,RET融合是肺癌驅動基因,在非小細胞肺癌患者中約1%-2%患者攜帶RET融合。在中國,RET融合陽性非小細胞肺癌患者每年新增1-2萬。RET融合的非小細胞肺癌患者被確診時大多已處於疾病晚期,且對於此類患者化療、免疫治療療效均有限。同時接近50%的RET融合非小細胞肺癌患者最終會發生腦轉移,而腦轉移患者1年的生存率僅為14%,臨床上有巨大的未滿足治療需求。
值得一提的是,據悉,在年初的摩根大通醫療健康大會(JPM)上,信達生物預計2027年將由15-20款上市產品,並預計在4-5年内營業收入達到200億元。
綜合來看,隨著不斷有產品實現商業化,信達生物預期自己的營收將在未來幾年内繼續大幅增長,而在這種情況下,其盈利狀況也有望得到改善。
