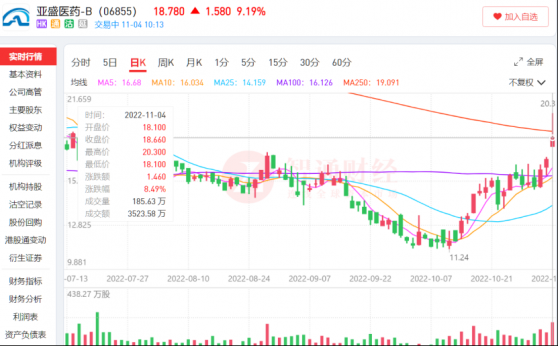
11月4日早盤,亞盛醫藥-B(06855)股價跳空高開,最高達到20.3港元,漲幅達到18%。在連續叁個交易日上漲後,亞盛醫藥股價也來到了近4個月來的新高。近2個月,公司股價區間最高漲幅達到80.6%。
市場之所以有如此積極的反饋,在于前一日亞盛醫藥宣布,公司向第64屆美國血液學會(American Society of Hematology,ASH)年會遞交的4項臨床階段研究數據全部入選口頭報告,全球創新實力再獲驗證。
一年一度的ASH年會是全球血液學領域規模最大的國際學術盛會之一,全面涵蓋了血液疾病的病因研究和治療研究。第64屆ASH年會將于2022年12月11日至14日在美國新奧爾良以線下結合線上的形式舉行。
今年,亞盛醫藥核心品種、首個商業化産品、原創1類新藥奧雷巴替尼(商品名:耐立克®)共有3項臨床進展獲選年會口頭報告。
這是該品種的臨床進展連續第五年入選ASH年會口頭報告,五連冠的佳績充分體現國際血液學界對其療效和安全性的認可,也體現出奧雷巴替尼的創新含金量以及亞盛硬核的研發實力。
值得一提的是,耐立克®在美國慢性髓細胞白血病(CML)和費城染色體陽性急性淋巴細胞白血病(Ph+ ALL)患者中的有效性和安全性數據爲亞盛醫藥首次公布,且一經公布即入選口頭報告。
數據顯示,耐立克®在難治性CML和Ph+ ALL患者中的有效性和耐受性良好,即使在ponatinib或asciminib耐藥的患者中,亦顯現出很強的療效。這表明耐立克®有望成爲全球首個能有效克服ponatinib或asciminib耐藥的新一代BCR-ABL抑制劑。
耐立克®另外兩項入選口頭報告的研究分別爲其治療T315I突變耐藥CML患者的關鍵II期注冊臨床研究的最新數據,和其用于中國CML耐藥患者的5年長期隨訪數據(I期臨床研究),進一步驗證安全性和有效性。去年,耐立克®就是憑借關鍵II期注冊臨床研究的數據斬獲上市,成爲中國首個且唯一獲批上市的治療攜T315I突變耐藥慢性髓細胞白血病的藥物,充分體現了本土創新、全球領先。
同時,公司細胞凋亡管線重要品種Bcl-2選擇性抑制劑APG-2575單藥或聯合治療初治、複發或難治(R/R)慢性淋巴細胞白血病/小淋巴細胞淋巴瘤(CLL/SLL)患者的全球II期臨床研究初步數據也成功獲選ASH年會口頭報告。該數據也是公司首次披露,備受國際業界和市場雙重期待。
作爲全球第二個、國內首個看到明確療效、並進入關鍵注冊臨床階段的Bcl-2抑制劑,APG-2575在此次ASH年會口頭報告的數據體現了該品種在R/R CLL/SLL患者中強勁的單藥和聯合治療潛力。
數據顯示:APG-2575聯合acalabrutinib治療R/R CLL/SLL的客觀緩解率(ORR)達98%;APG-2575聯合利妥昔單抗治療的ORR達87%。此外, 單藥治療的研究結果和前期臨床研究結果相似,再次展現了APG-2575優秀的療效和安全性;而聯合治療的研究,特別是和acalabrutinib的聯合治療的研究結果,顯示了超高的有效率。同時在腫瘤溶解綜合征(TLS)的發生率和血液學不良事件等方面,聯合治療也保持了與APG-2575單藥治療相當的出色安全性。
亞盛醫藥首席醫學官翟一帆博士表示:“今年,亞盛醫藥共有四項臨床數據入選ASH年會口頭報告,可謂是大豐收,我們對此感到非常激動。
其中,耐立克®共獲叁個ASH年會口頭報告,創下了‘五連冠’的新曆史,這是國際血液學界對該品種的巨大認可。此次亞盛醫藥首次公布的耐立克®海外研究數據表明,該品種有望成爲全球首個能有效克服ponatinib和asciminib耐藥的BCR-ABL抑制劑。這意味着耐立克®有潛力進一步解決全球CML患者急需、改變全球CML治療格局,這讓我們無比振奮。
此外,APG-2575取得的成績也非常亮眼。APG-2575是首個在中國進入臨床階段的、本土研發的Bcl-2抑制劑,也是全球第二個、國內首個看到明確療效、並進入關鍵注冊臨床階段的Bcl-2抑制劑。此前,亞盛醫藥多次公布了該品種單藥治療R/R CLL/SLL患者的積極數據,獲業界認可和關注。
Bcl-2抑制劑與BTK抑制劑的聯合治療前景一直備受關注與期待。而今年,APG-2575將在ASH年會上口頭報告的其首次聯合acalabrutinib/利妥昔單抗治療R/R CLL/SLL患者的數據呈現了良好的安全性和療效,進一步表明該品種在聯合治療領域具有巨大潛力和臨床價值,這令我們無比振奮。
未來,我們將進一步加快公司在研品種在全球層面的臨床開發。早日造福中國乃至全球的患者。”
亞盛醫藥入選2022 ASH年會口頭報告的研究摘要如下:
Olverembatinib (HQP1351) Overcomes Ponatinib Resistance in Patients with Heavily Pretreated/Refractory Chronic Myeloid Leukemia (CML) and Philadelphia Chromosome-Positive Acute Lymphoblastic Leukemia (Ph+ ALL)
奧雷巴替尼(HQP1351)可克服既往接受過深度治療/難治性慢性髓細胞白血病(CML)和費城染色體陽性急性淋巴細胞白血病(Ph+ ALL)患者對于Ponatinib的耐藥
展示形式:口頭報告
摘要編號:162387
分會場:632.慢性髓細胞白血病:臨床及流行病學進展:新型藥物
Session: 632. Chronic Myeloid Leukemia: Clinical and Epidemiological: Novel Agents
l報告時間:美國東部時間2022年12月10日,星期六,上午10:15 /北京時間2022年12月10日,星期六,晚上11:15
Time: Saturday, December 10, 2022, 10:15 AM (Eastern Time) / Saturday, December 10, 2022, 11:15 PM (Beijing Time)
核心要點:
奧雷巴替尼是一種新型的第叁代BCR-ABL1 TKI,對 CML 和 Ph+ ALL 具有抗腫瘤活性,且耐受性良好。
這項多中心、開放標簽、隨機對照的臨床研究首次報告了奧雷巴替尼在中國以外的CML和Ph+ ALL患者中的安全性、有效性和藥代動力學(PK)特征。這些患者至少對2種BCR-ABL1抑制劑耐藥或不耐受,其中包括ponatinib和asciminib;但攜帶T315I突變的患者既往治療線數不受限制。患者以3:3:2的比例隨機分配到奧雷巴替尼30、40或50mg 的試驗組中,采用隔日給藥(QOD)的方式,28天爲一個治療周期。
共有30例患者入組,其中包括CML-CP患者 23例,CML-AP患者4例,CML急變期(-BP)患者2例,Ph+ ALL 患者1例。他們的中位(範圍)治療持續時間爲4.8(0.03-21.29)個月,從診斷爲CML或Ph+ ALL到開始使用奧雷巴替尼治療的中位(範圍)時間爲7.0(1.5-24.0)年。半數(15/30)患者爲男性,中位(範圍)年齡爲47.0(21.0-74.0)歲。在這些患者中,分別有1(3.3%)、7(23.3%)、8(26.7%)和9(30.0%)例患者曾經接受過2、3、4和≥5種TKI治療;共有21例(70.0%)的患者曾經接受過第叁代TKI ponatinib治療,其中耐藥17例(81.0%),不耐受4例(19.0%);共有5例(16.7%)患者曾經使用過asciminib;共有12例(40.0%)患者伴有T315I 突變;共有13例患者(43.3%)有高血壓。
安全性:奧雷巴替尼的耐受性良好,22例(73.3%)患者經曆了任何級別的治療相關不良反應(TRAE),其發生率呈劑量依賴性。大多數非血液學TRAE爲 1/2級;常見的3/4級血液學TRAE包括血小板減少症(7/30;23.3%)、中性粒細胞減少(5/30;16.7%)和白血球減少症(4/30;13.3%)。在所有30例患者中,有11例(36.7%)出現了嚴重不良反應(SAE),其中6例(20.0%)被認爲與奧雷巴替尼相關並有1例(3.3%)中斷治療。來自50 mg劑量組的一例CML-AP患者死于疾病進展(PD)。
初步療效:奧雷巴替尼在CML和Ph+ ALL患者中具有強效的抗白血病活性。在21例療效可評估的患者中,10/17例(58.8%)獲得完全細胞遺傳學反應(CCyR);9/21(42.9%)的患者獲得主要分子反應(MMR)。奧雷巴替尼對T315I突變的患者(62.5%,CCyR;50%, MMR)和不伴有T315I突變的患者(55.6%,CCyR;38.5%,MMR)都有效,其有效性並未因先前使用過ponatinib或asciminib而受到影響。對ponatinib耐藥的患者中有5/9例(55.6%)獲得CCyR,6/11例(54.5%)獲得了MMR。使用過asciminib的5例患者中有4 例獲得緩解。PK分析表明,奧雷巴替尼的血漿暴露量從30到50mg QOD呈劑量比例增加,中國和美國CML患者群體的血漿暴露量相當。
結論:奧雷巴替尼在難治性CML和Ph+ ALL患者中具有良好的有效性和耐受性。即使在ponatinib或asciminib耐藥或有T315I 突變的患者中,其也顯示出很強的療效。該研究證實,奧雷巴替尼是CML和Ph+ ALL患者的一種潛在治療選擇,包括那些ponatinib治療失敗或T315I突變的患者。
Updated Results of Pivotal Phase 2 Trials of Olverembatinib (HQP1351) in Patients (Pts) with Tyrosine Kinase Inhibitor (TKI)-Resistant Chronic- and Accelerated-Phase Chronic Myeloid Leukemia (CML-CP and CML-AP) with T315I Mutation
奧雷巴替尼(HQP1351)治療酪氨酸激酶抑制劑(TKI)耐藥的T315I突變慢性髓細胞白血病慢性期和加速期(CML-CP和CML-AP)患者的關鍵性II期臨床試驗最新結果
展示形式:口頭展示
摘要編號:170698
分會場:632. 慢性髓細胞白血病:臨床及流行病學進展:新型藥物
Session: 632. Chronic Myeloid Leukemia: Clinical and Epidemiological: Novel Agents
報告時間:美國東部時間2022年12月10日,星期六,上午10:30/北京時間2022年12月10日,星期六,晚上11:30
Time: Saturday, December 10, 2022, 10:30 AM (Eastern Time) / Saturday, December 10, 2022, 11:30 PM (Beijing Time)
核心要點:
T315I突變可産生高度的耐藥性,對第一代和第二代TKIs都具有高度耐藥性。奧雷巴替尼是一種新型的具有口服活性的第叁代BCR-ABL1 抑制劑,在I期試驗結果良好的基礎上,開展了HQP1351-CC-201和HQP1351-CC-202兩個關鍵性臨床試驗,研究數據顯示在伴隨T315I突變的CML-CP以及CML-AP的患者治療中,奧雷巴替尼表現出很強的療效以及良好的耐受性。
HQP1351-CC-201研究(CML-CP)
截止到2022年4月30日,共有41名患者入組,其中21名(51.2%)爲男性,中位(範圍)年齡爲47(22-70)歲,從診斷爲CML到首次服用奧雷巴替尼的中位時間爲5.31(0.6-23.2)年,32名(78.1%)患者既往接受過≥2種TKIs。中位(範圍)治療時間爲32.7(3.1-36.7)個月。
初步療效:100%的CML-CP患者獲得完全血液學反應(CHR)(31/31,其他10名患者在基線時即爲CHR),34/41(82.9%)獲得主要細胞遺傳學反應(MCyR),29/41 (70.7%)獲得 CCyR,24/41 (58.5%)獲得MMR。獲得CHR的中位時間爲1個月(95% CI:1.0-1.9),獲得MCyR的中位時間爲2.8個月(95% CI:2.8-5.6),獲得MMR的中位時間爲6.5個月(95% CI:2.8至未達到[NR])。36個月時的無進展生存率(PFS)爲86.3%(95% CI:70.2%-94.1%),總生存率(OS)爲95.1%(95% CI:81.9%-98.8%)。共有5名患者因PD退出,4名患者因不耐受退出,3名患者同意退出,2名患者因其他原因退出。
安全性:常見的TRAE(所有級別;3-4級;SAEs)依次爲血小板減少症(70.7%;48.8%;7.3%)、貧血(70.7%;31.7%;2.4%)、白血球減少症(51.2%;14.6%;0)、中性粒細胞減少症(41.4%;21.9%;0)。常見非血液學TRAE(所有分級; 3-4級)包括皮膚色素沉着(56.1%;0%)和肌酸激酶升高(56.1%;19.5%)、谷丙轉氨酶(ALT)升高(43.9%;2.4%)和谷草轉氨酶(AST)升高(36.6%;0)。
HQP1351-CC-202研究(CML-AP)
截止到2022年4月30日,共有23名患者入組,其中18名(78.3%)爲男性,中位(範圍)年齡爲41(21-74)歲,患者從診斷爲CML到首次使用奧雷巴替尼治療的時間爲4.96(0.4-10.2)年,19名(82.6%)患者既往接受≥2種TKIs。中位(範圍)治療時間爲19.7 (1.4-36.4)個月。
初步療效:共有18(78.3%)例患者獲得主要血液學反應(MaHR)(73.9% CHR和4.4%無白血病證據[NEL]);12(52.2%)例患者獲得MCyR;12(52.2%)例患者獲得CCyR;11(47.8%)例患者獲得MMR。獲得MaHR的中位時間爲2.8個月(95% CI:1.0-4.7);獲得MCyR的中位時間爲5.6個月(95% CI:2.00-NR);獲得MMR的中位時間爲13.1個月(95% CI:5.6-22.4)。36個月時,PFS率爲57.1%(95% CI:33.3%-75.1%),OS率爲69.6%(95% CI:46.6%-84.2%)。6例患者因PD退出,4例患者不耐受, 1例患者有其他原因,2例患者死亡。
安全性:常見的TRAE(所有級別;G3-4;SAEs)包括血小板減少症(78.3%;56.5%;17.4%)、貧血(69.6%;34.8%;13.0%)、白血球減少症(56.5%;30.4%;0)、中性粒細胞減少症(26.1%;26.1%;0);常見的非血液學不良事件包括皮膚色素沉着(69.6%)、低鈣血症(52.2%)、蛋白尿(56.5%)、高甘油叁酯血症(60.9%)、高磷血症(47.8%)、高尿酸血症(26.1%)和關節痛(34.8%),其中以1-2級居多。
結論:奧雷巴替尼對TKI耐藥且伴有T315I突變的CML-CP和CML-AP患者具有良好的有效性和耐受性。基于這些關鍵性臨床試驗的結果,中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)已于2021年11月附條件批准奧雷巴替尼上市。
A Five-Year Follow-up on Safety and Efficacy of Olverembatinib (HQP1351), a Novel Third-Generation BCR-ABL Tyrosine Kinase Inhibitor (TKI), in Patients with TKI-Resistant Chronic Myeloid Leukemia (CML) in China
新型第叁代BCR-ABL酪氨酸激酶抑制劑(TKI) 奧雷巴替尼(HQP1351)在中國TKI耐藥慢性髓細胞白血病(CML)患者中的5年安全性和有效性隨訪數據
展示形式:口頭報告
摘要編號:170868
分會場:632. 慢性髓細胞白血病:臨床及流行病學進展:新型藥物
Session: 632. Chronic Myeloid Leukemia: Clinical and Epidemiological: Novel Agents
時間:美國東部時間2022年12月10日,星期六,上午10:00/北京時間2022年12月10日,星期六,晚上11:00
Time: Saturday, December 10, 2022, 10:00 AM (Eastern Time) / Saturday, December 10, 2022, 11:00 PM (Beijing Time)
核心要點:
這項在中國進行的開放性、多中心的I期臨床試驗評估了奧雷巴替尼在成年CML-CP或CML-AP患者中的安全性和有效性5年長期隨訪數據。符合條件的患者包括對第一代或第二代TKIs耐藥或不耐受的CML-CP或CML-AP患者。奧雷巴替尼的使用方式爲口服、QOD、28天爲一個周期,共有範圍從1至60mg的11個劑量組。
從2016年10月26日至2022年4月30日(數據截止日期),101例CML-CP(n=86)和CML-AP(n=15)患者入組並接受了奧雷巴替尼治療。中位治療時間爲44.7(1.2-63.1)個月。71例(70.3%)患者爲男性,中位年齡爲40歲(範圍20-64歲),從診斷到首次接受奧雷巴替尼治療的中位(範圍)時間爲6.0年(0.3-15.2年)。84例(83.2%)患者接受了≥2種TKI治療,63例(62.4%)患者攜帶T315I突變。在基線時,12例(11.9%)患者檢測到複合突變,其中8例(66.7%)攜帶BCR-ABL1T315I突變。共有20例(19.9%)患者有2(n=13)或≥3(n=7)種突變。截至數據截止日期,101例患者中72例(71.3%)繼續治療,28例(21例CML-CP和7例CML-AP)因疾病進展、不耐受或其他原因停止治療。累積藥物暴露的中位劑量數(範圍)爲20,175(660-34,395)mg。101例患者中,79例(78.2%)治療>3年,21例(20.8%)治療>4年,3例(3.0%)治療>5年。
初步療效:在可評估的CML-CP患者中,100%的患者獲得了CHR,80%獲得了MCyR,71.3%獲得CCyR,55.3%獲得MMR;在可評估的CML-AP患者中,CHR占85.7%,MCyR、CCyR和MMR各占40%。在可評估的T315I突變患者中,CMP-CP患者的CHR爲100%,MCyR爲83.7%,MMR爲73.1%;CML-AP患者的CHR爲80.0%,MCyR和MMR各爲54.5%。CML-CP患者48個月的PFS率爲85.6%(95% CI:70.6%-93.3%);CML-AP患者48個月的PFS率爲50.0%(95% CI:22.9%-72.2%); 奧雷巴替尼在複合突變的CML患者中表現出顯著的療效。12例經新一代基因測序技術確認攜帶複合突變的患者中,7例(58.0%)達到MMR;3(25.0%)例達到MR4.5。截止到最後一次隨訪時,3例患者進展到CML-AP或CML-BP並死亡,7例仍在接受奧雷巴替尼治療,其中1例獲得MMR,CHR、CCyR和MR4.5各2例。
安全性:大多數TRAE爲1級或2級。最常見的非血液學不良事件爲(多爲1級或2級)皮膚色素沉着(85.1%);≥3級非血液學AEs包括高甘油叁酯血症(10.9%)、發熱(6.9%)和蛋白尿(6.9%)。最常見的血液學相關不良事件爲血小板減少症,在79例(78.2%)患者中發生,其中52例(51.5%)≥3級和7例(6.9%)SAE;21例(20.8%)白血球減少症≥3級,無SAE;17例(16.8%)貧血≥3級,4例(4.0%)SAE。
結論:這項首次在人體實驗的5年隨訪結果顯示,奧雷巴替尼在前期接受過重度治療的CML患者中具有持久療效和良好的耐受性。
Lisaftoclax (APG-2575) Safety and Activity As Monotherapy or Combined with Acalabrutinib or Rituximab in Patients (pts) with Treatment-Naïve, Relapsed or Refractory Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma (R/R CLL/SLL): Initial Data from a Phase 2 Global Study
Lisaftoclax(APG-2575)單藥或與Acalabrutinib/利妥昔單抗聯合治療在初治、複發或難治的慢性淋巴細胞白血病/小淋巴細胞淋巴瘤(R/R CLL/SLL)患者中的安全性和抗腫瘤活性:來自一項II期全球性臨床研究的初步數據
展示形式:口頭報告
摘要編號:160386
分會場:642.慢性淋巴細胞白血病:臨床及流行病學:在研藥物和新冠病毒感染
報告時間:美國東部時間2022年12月12日,星期一,下午5:15/北京時間2022年12月13日,星期二,早上6:15
核心要點:
APG-2575是一種特異性Bcl-2抑制劑,在R/R CLL/SLL患者中具有活性,包括經BTKi治療後疾病進展(PD)且伴有del(17p)的患者。這是APG-2575聯合acalabrutinib或利妥昔單抗用于R/R CLL/SLL患者的數據首次報告。
患者每天單獨口服APG-2575(400mg,600mg和800mg)或與acalabrutinib/利妥昔單抗聯用6個周期,每28天爲一周期。主要目的爲確定II期研究推薦劑量(RP2D)、安全性和有效性,包括APG-2575單藥及聯合acalabrutinib或利妥昔單抗的ORR。在監測腫瘤溶解綜合征(TLS)前提下,患者采用每天梯度遞增給藥的方式,4-6天後可達到最終目標劑量:第1天(D1)20mg,D2 50mg,D3 100mg,D4 200mg,D5 400mg。隨後第1周期第1天(C1D1)APG-2575 的目標劑量爲400、600或800mg。聯合治療組中的患者在完成梯度遞增給藥達到目標劑量後,繼續接受額外7天的APG-2575先導治療,然後在C1D8時加入acalabrutinib/利妥昔單抗,直至PD或者觀察到不可耐受的毒性。
截止2022年7月4日,共入組141例患者。中位年齡62歲(18-80)。98例(70%)爲男性,125例(89%)患者的東部腫瘤協作組(ECOG)評分爲0-1分,15例(11%)爲2分。既往中位治療線數爲2線(1-15)。17例(12%)患者既往使用過BTKi(n=15)和/或venetoclax(n=3)治療出現PD。聯合組中(n=95),其中TP53突變或伴del(17p)有39例(41%),del(11q)有27例(28%),IGHV未突變有36例(38%),IGHV突變有14例(15%),47%未知。中位使用APG-2575 10(0-30)個周期,包括單藥組16.5個周期,利妥昔單抗聯合組9(1-15)個周期,acalabrutinib聯合組7(0-18)個周期。3例(2%)基線存在巨大腫塊的患者報告TLS(2例臨床,1例實驗室),2例臨床TLS的患者最終均完全恢複。聯合組中,C1D8加入acalabrutinib/利妥昔單抗後,未觀察到任何TLS發生。
安全性:常見的(>5%)任何級別的不良反應(AE)包括:粒細胞減少(30%,3/4級爲26%),新冠病毒感染(26%),貧血(24%,3/4級爲12%),腹瀉(20%),血小板減少(17%,3/4級爲5%),高尿酸血症或發熱(各9%),惡心、頭痛或疲勞(各占8%),谷草轉氨酶(AST)水平升高(7%),高磷血症(6%);肌酐升高(6%)。首次3級及以上的血細胞減少發生在梯度遞增或C1期間,罕見于C2(n=3 [2%])之後。13%患者在生長因子支持下≥3級的中性粒細胞減少的不良事件可控。未觀察到劑量限制毒性(DLT)。聯合治療組中未發現藥物相互作用。
初步療效:56%的患者在每天梯度遞增給藥結束後,淋巴細胞迅速恢複至正常水平。單藥組中,患者的ORR達65%(43例);acalabrutinib聯合組中,患者的ORR達98%(53例),利妥昔單抗聯合組中,患者的ORR達87%(23例)。
結論:在初治及R/RCLL/SLL患者中,每日梯度劑量遞增給藥的情況下,APG-2575單藥或與acalabrutinib/利妥昔單抗聯合治療的安全性可控,並展示出了優異的早期療效。