風口過後,生物醫藥靠“稀缺性”和一兩個在研管線撐起估值一片天的日子似乎也一去不複返了。對此,身處美股市場的亘喜生物(GRCL.US)或許深有感觸。
去年1月,亘喜生物初登美股便感受到了來自華爾街的熱情。上市當天,亘喜生物盤中股價大漲超50%,最終收漲31.89%,收盤價達到每股25.06美元,公司市值達到16.4億美元。
但此後,受中概股大環境以及生物醫藥行業風口轉向的影響,公司股價在一年內持續下跌。截至3月21日收盤,公司股價僅剩每股2.16美元,市值較上市時下滑91%。而就在這一周前,亘喜生物剛公布其2021年Q4季度及全年業績。
財報凸顯“未來可期”
按照以往的生物醫藥投資邏輯,管線的稀缺性、相關研發進展以及順利程度往往會決定投資者的心態。對于一家未盈利的生物創新研發公司而言,投資者希望看到的是在一個完整年度中,公司核心管線研發取得顯著進展。
對于亘喜生物,其管線稀缺性自不必多說。與全球多數致力于CAR-T療法的“技術流”們不同,亘喜生物的研發更聚焦于解決這一賽道的普遍困難。
在全球範圍內,CAR-T療法普遍面臨的重大難題包括:治療實體瘤有效率低,細胞制備速度慢以及自體療法成本過高。這些問題極大地限制了CAR-T細胞療法的市場可及性,影響了研發公司的規模化盈利。只要能有效解決以上問題,就能建立極高的技術壁壘。
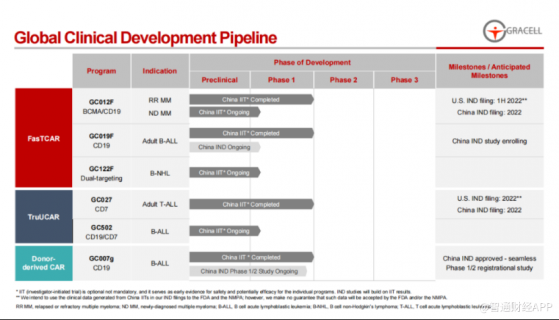
智通財經APP了解到,亘喜生物自主研發出FasTCAR 和 TruUCAR兩大技術平台便是其“傍身法寶”。
FasTCAR平台解決的是細胞制備速度慢的問題。在FasTCAR平台技術支持下,細胞制備能夠在24小時左右完成生産,這無疑極大提高了T細胞的生産效率。另一大核心TruUCAR平台技術,則致力于解決CAR-T自體療法的技術局限性。公司可利用該技術開發出源自無需HLA配型的健康供體的T細胞通用型CAR-T産品,有效降低治療成本,提高CAR-T細胞療法的市場可及性。
實際上,此次財報中,亘喜生物披露的主要也是這兩大技術平台下的管線研發進展。
2021年,在FasTCAR平台下,核心候選藥物GC012F目前正處于臨床研究階段,評估其治療MM和B-NHL的安全性及有效性。其在中國開展的、針對複發難治性 B-NHL的由研究者發起的臨床試驗(IIT)完成首批患者給藥,並在近期該産品還通過申請被授予了針對RR MM治療的孤兒藥資格認定。
除此之外,財報中提到的更多是GC012F後續的臨床研發規劃。例如,公司計劃于2022年下半年,在美國遞交針對RR MM適應症的臨床試驗申請(IND),該進度根據CDMO合作夥伴的産能限制做出了相應的調整;還預計2022年在中國提交針對RR MM適應症的臨床試驗申請(IND)。
而在TruUCAR平台下,財報中提到,CD19/CD7雙靶向同種異體CAR-T候選産品GC502,目前正在中國開展一項IIT研究,該研究旨在評估其治療B-ALL的安全性及有效性,其早期臨床數據將在4月12日的AACR年會上首次公布。
而用于治療T淋巴細胞白血病(T-ALL)的靶向CD7的同種異體CAR-T候選産品GC027則計劃在未來12個月間與海外及中國監管機構開展溝通。
除此之外,亘喜生物還在財報中提到其最新研發的第二代針對實體瘤的增強型CAR-T細胞療法SMART CART平台。據智通財經APP了解到,依托于獨特的結構設計,SMART CART能通過利用並扭轉腫瘤微環境(TME)的抑制性信號,進而有效地攻擊實體瘤;基于該平台打造的産品旨在強化CAR-T細胞的擴增能力及持續殺傷腫瘤的能力,並通過改善CAR-T細胞的持久性以延緩耗竭。
在該平台的技術支持下,亘喜生物有望2022年在中國啓動GC503針對包括卵巢癌在內的間皮素陽性實體瘤的IIT研究。另外公司還籌備在中國啓動GC506針對CLDN18.2陽性實體瘤的IIT研究。
不難看到,雖然相比公司上市時僅有2款産品處在1期臨床,到2021年Q4季度,公司研發管線中達到1期臨床階段的産品已達到4款,並且在細胞療法治療實體瘤的研發中,亘喜生物也有了長足進步,但毫無疑問的是,公司當前的研發管線離産品實現商業化仍有一段距離,在細胞療法賽道迅速發展的當下只能說“未來可期”。
而公司股價和估值出現持續下滑,原因或許在于公司的研發進度趕不上全球生物醫藥投資風口轉變的速度。
如何在“後紅利”投資環境下突圍?
毫無疑問,現在的國內生物醫藥發展正處在未盈利生物藥企紅利末期。
在這個紅利期階段,集采政策的出台給了國內市場依賴高增長,高毛利,高銷售費用的傳統生物醫藥行業敲響了警鍾;同時未盈利企業IPO政策的出台,疊加上CXO服務的興起,給衆多創新創業者及資本,提供了足夠大的想象空間。
這個階段最明顯的特征便在于Biotech公司如同雨後春筍般的破土而出。
然而隨着一方面仿制藥集采價格屢創新低,持續的集采會不斷壓低企業利潤;另一方面,創新藥也遇到各種各樣的挑戰,無論在醫保價格、市場規模、競爭格局還是國際化進程上都遇到了麻煩。而資本市場的表現,更是給了生物醫藥産業持續的打壓,這使得無論是國內市場還是海外市場,都對生物醫藥企業越來越不友好。
實際上,“不友好”的原因多半來自于投資風向的轉變。未盈利生物藥企估值紅利期的結束,或與當前不確定的宏觀環境以及疫情出現導致全球産業鏈停擺,進一步促進中國生物醫藥産業在全産業鏈布局以及國際化布局的前進步伐有關。
資金在面對二級市場震蕩時,挖掘具有強大“體系化競爭”優勢、具備收入確定性與國際化先發布局的標的,通常會成爲獲得正收益的關鍵要素,這也是市場最近更傾向Biopharma價值的重要原因。
不過對于亘喜生物而言,其研發能力及研發方向稀缺性自然毋庸置疑。
在傳統的自體治療策略下,需要針對每個病人定制化的産品,每個批次的産品需要使用病人自體的T細胞,在應用前需要進行嚴格的分離篩選,轉導激活,灌裝質檢冷鏈運輸,最後輸回病人體內。整個流程耗時2-4周的時間。
抽象來看,細胞的制備其實是根據終端需求訂單式生産,病人數量的不穩定導致公司無法對T細胞進行穩定的排産。並且細胞制備背後的固定成本,如生産廠房設備折舊、租金,員工支出以及水電等屬于剛性支出,因此不能持續滿負荷進行細胞制備,將極大提高公司的成本。
FasTCAR和TruUCAR兩大技術之所以是革命性的,在于其從時間和空間兩個維度提高了T細胞制備的效率。尤其是通用CAR-T細胞的研發,有望將細胞制備從治療周期中順利剝離,將CAR-T細胞療法從定制化的自體策略中“解放”出來。這也是細胞療法走向工業化和規模化的基礎。擴大市場可及性,意味着細胞制備的排産有望趨于穩定,這將有助于公司實現跨越式的降本提效,形成相對同行的牢不可破的護城河。
但以上也僅是細胞治療企業走向規模化市場的第一步。由于醫藥行業與普通制造業不同,産品安全性要求保證嚴格的質量控制和監測,這也是CAR-T生産過程的重中之重。
參考吉利德對于Yescarta的生産質控,主要是從6個方面進行的。生産的原材料試劑、在線監測、在線控制測試、批次發布測試、使用身份鏈系統實現可追溯性以及制造流程的驗證、監控和追溯。這套質量控制體系沿用了前列腺癌DC腫瘤疫苗Provenge的質量管理體系和技術標准,Norvatis和Juno的質量控制體系也沿用了該理念。
在資本市場更注重生物醫藥企業商業化能力以及成長確定性的當下,針對亘喜生物價投的關鍵節點或已從此前的研發管線突出進展,轉移到公司的關鍵商業化推進上。因此投資者押注所看重的要點在于公司的降本增效以及規模制備的産能及效率上。
值得一提的是,目前亘喜生物的研發方向正是爲了解決細胞療法規模制備的效率及成本問題。財報中也提到,FasTCAR平台目前已經可實現次日生産完畢的自體CAR-T細胞療法,較大提高了産品制備效率。因此對于亘喜生物而言,目前的股價和估值仍沒到終點,待其産品商業化推進到關鍵期,投資者或可對其內在價值進行重新研判。